Tableau périodique des éléments : Différence entre versions
| Ligne 32 : | Ligne 32 : | ||
<hr> | <hr> | ||
| − | <center>[[Image:Tableau_%C3%A9l%C3% | + | <center>[[Image:Tableau_%C3%A9l%C3%A9ments_1bis.jpg]]</center><br> |
<b><font color="#0000FF">Pour voir le tableau en plus grand, voir :</font> [[Le tableau des éléments]]</b><br> | <b><font color="#0000FF">Pour voir le tableau en plus grand, voir :</font> [[Le tableau des éléments]]</b><br> | ||
<hr> | <hr> | ||
Version du 5 avril 2010 à 06:21
- Pendant l'Antiquité, on considérait les éléments différemment : les corps étaient classés en solides, liquides et vapeurs et selon leur couleur, et leur interaction suivant des notions de sympathie et d'antipathie. Cette philosophie reposait sur la théorie des quatre éléments (le feu, l’eau, la terre et l’air) d'Aristote reprise par Platon. (Voir l'histoire de la chimie).
- Origine des éléments (Suivre le lien), à noter que les tout premiers éléments formés naturellement se retrouvent en haut du tableau (ligne 1 : hydrogène et hélium), et les éléments synthétisés par l'homme sont en bas dui tableau (voir le tableau ci dessous).
- Les éléments chimiques sont une catégorie d'atomes ayant en commun le même nombre de protons dans leur noyau atomique. Un atome est un assemblage de protons, de charge positive, et de neutrons, de charge nulle, le tout entouré d'électrons de charge électrique négative. les atomes peuvent se combiner de façons très variables. Sous forme pure, ils peuvent se présenter notamment comme des atomes séparés, comme des molécules comprenant plusieurs atomes d'un même élément, comme des solides cristallins ou amorphes.

- Tableau périodique des éléments: ou tableau de Mendeleïev, regroupe tous les éléments avec leur numéro atomique, la masse atomique, le nom, le symbole... Ce tableau est dit périodique car tous les éléments situés dans une même colonne (de 1 à 18), présentent des propriétés chimiques proches. Par exemple : dans la colonne 1, le lithium (Li) et le sodium (Na) ont un comportement chimique proche. L'explication de ce comportement repose sur le fait que le nombre d'électrons de leur couche de valence (tous les électrons présents en plus de la configuration du dernier gaz rare) est identique. Li et Na ont un seul électron de valence. C'est cet électron externe qui est disponible pour les réactions chimiques. D'où des propriétés chimiques proches et par conséquent leur regroupement dans une même famille d'éléments.
- Les éléments sont groupés en :
- métaux à gauche du tableau :
- métaux alcalins,
- métaux alcalino-terreux,
- les lanthanides : Z = 57 à 71,
- les actinides : Z = 89 à 103,
- les métaux de transition (colonnes 3 à 12),
- métaux pauvres entre les métalloïdes et les métaux de transition (Al, Ga, In, Sn, Tl, Pb, Bi),
- métalloïdes : entre les deux précédents (B, Si, Ge, As, Sb, Te, Po),
- non-métaux à droite du tableau :
- halogènes : colonne 17,
- gaz nobles : colonne 18.
- métaux à gauche du tableau :
- Certaines familles d'éléments d'une même colonne ont reçu des noms :
- 1 : métaux alcalins,
- 2 : métaux alcalino-terreux,
- 14 : cristallogènes,
- 15 : pnictogènes,
- 16 : chalcogènes,
- 17 : halogènes,
- 18 : gaz nobles.
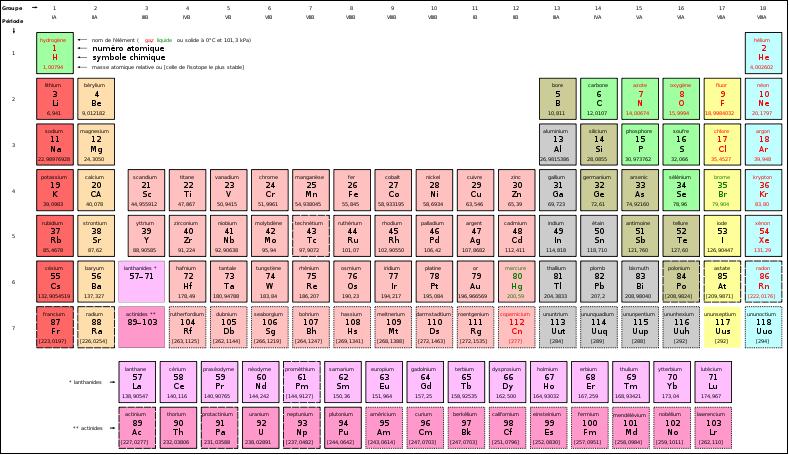
Pour voir le tableau en plus grand, voir : Le tableau des éléments
- Une autre version (plus ancienne) du tableau périodique des éléments se trouve à :FORMULES CHIMIQUES et à Mendeleïev.
On connait actuellement 117 éléments (du 1 au 118, à l'exception du 117) dont 92 existent à l'état naturel sur Terre.
- Il vous est possible de consulter une Liste alphabétique des éléments naturels, leurs symboles et classes.
Retour aux différentes listes