La détermination des minéraux : Différence entre versions
| Ligne 249 : | Ligne 249 : | ||
L'analyse par voie humide donne des resultats absolument fiables mais necessite aussi un certain nombre de reactifs chimiques de laboratoire (et certains sont dangereux). | L'analyse par voie humide donne des resultats absolument fiables mais necessite aussi un certain nombre de reactifs chimiques de laboratoire (et certains sont dangereux). | ||
| − | Elle consiste grossierement a ajouter des reactifs chimiques a la matiere minerale a analyser dans le but d'observer des reactions caracteristiques (precipités colorés...). Pour cela, le mineral est generalement mis en solution dans un acide fort au prealable ( | + | Elle consiste grossierement a ajouter des reactifs chimiques a la matiere minerale a analyser dans le but d'observer des reactions caracteristiques (precipités colorés...). Pour cela, le mineral est generalement mis en solution dans un acide fort au prealable (HNO<sub>3</sub> concentré le plus souvent).<br> Il existe ainsi des reactions caracteristiques pour de nombreux elements (ex: Fer, Bismuth, Cuivre...), ou bien pour des groupements anioniques donnés (carbonates, phosphates...) |
| − | Il existe ainsi des reactions caracteristiques pour de nombreux elements (ex: Fer, Bismuth, Cuivre...), ou bien pour des groupements anioniques donnés (carbonates, phosphates...) | ||
| − | *<b>Le materiel de base:</b> un peu de verrerie (un filtre conique en verre, un becher en verre Pyrex, un agitateur en verre), du papier filtre de chimie, une pince pour manipuler la verrerie a chaud, etc... | + | *<b>Le materiel de base:</b> un peu de verrerie (un filtre conique en verre, un becher en verre Pyrex, un agitateur en verre), du papier filtre de chimie, une pince pour manipuler la verrerie a chaud, etc...<br> Ne pas oublier une paire de gants de chimie et surtout des lunettes de protection pour proteger vos yeux lorsque vous manipulerez des produits fortement corrosifs!!! (une blouse de chimie en cotton est aussi recommandable) |
| − | Ne pas oublier une paire de gants de chimie et surtout des lunettes de protection pour proteger vos yeux lorsque vous manipulerez des produits fortement corrosifs!!! | ||
| − | (une blouse de chimie en cotton est aussi recommandable) | ||
| − | *<b>Les produits chimiques de base: </b>acide nitrique concentré (68%), acide chlorhydrique (a 30 %) et acide sulfurique (a 30 a 37%), ammoniaque (20-30%), et hydroxide de sodium (30%)Ces produits se trouvent tous dans les magasin de bricolage et quincailleries du style casto-brico-truc, a l'exception de l'acide nitrique qui ne peut etre obtenu que par le biais de fournisseurs specialisés en produits chimiques et dont la vente est surveillée (pour des raisons...explosives!). | + | *<b>Les produits chimiques de base: </b>acide nitrique concentré (68%), acide chlorhydrique (a 30 %) et acide sulfurique (a 30 a 37%), ammoniaque (20-30%), et hydroxide de sodium (30%)Ces produits se trouvent tous dans les magasin de bricolage et quincailleries du style "casto-brico-truc", a l'exception de l'acide nitrique qui ne peut etre obtenu que par le biais de fournisseurs specialisés en produits chimiques et dont la vente est surveillée (pour des raisons...explosives!). |
A noter que l'acide nitrique est tres dangereux, d'une part parcequ'il est extremement corrosif, mais aussi parcequ'il peut engendrer des incendies et de violentes explosions par simple contact avec certaines substances chimiques (notemment les substances organiques, comme par exemple les solvants organiques et les hydrocarbures, entre autres) | A noter que l'acide nitrique est tres dangereux, d'une part parcequ'il est extremement corrosif, mais aussi parcequ'il peut engendrer des incendies et de violentes explosions par simple contact avec certaines substances chimiques (notemment les substances organiques, comme par exemple les solvants organiques et les hydrocarbures, entre autres) | ||
| Ligne 267 : | Ligne 264 : | ||
===L'analyse qualitative par voie seche:=== | ===L'analyse qualitative par voie seche:=== | ||
| − | Celle-ci demande des moyens plus reduits que l'analyse par voie humide mais elle n'est pas entierement fiable (un peu plus approximative) | + | Celle-ci demande des moyens plus reduits que l'analyse par voie humide mais elle n'est pas entierement fiable (un peu plus approximative).<br> On pourra distinguer differents tests appartenant a cette categorie: |
| − | On pourra distinguer differents tests appartenant a cette categorie: | ||
*<b>determination de la fusibilité et de la couleur de la flamme:</b> on observe la couleur de la flamme pendant le chauffage, ainsi que la couleur de la flamme apres avoir trempé brievement l'echantillon dans HCl. On observe si le mineral fond facilement, moyennement, difficilement ou pas du tout. On observe l'eventuel residu de fusion obtenu, son aspect et ses proprietes particulieres s'il en est. (voir chapitres spécifiques ci après) | *<b>determination de la fusibilité et de la couleur de la flamme:</b> on observe la couleur de la flamme pendant le chauffage, ainsi que la couleur de la flamme apres avoir trempé brievement l'echantillon dans HCl. On observe si le mineral fond facilement, moyennement, difficilement ou pas du tout. On observe l'eventuel residu de fusion obtenu, son aspect et ses proprietes particulieres s'il en est. (voir chapitres spécifiques ci après) | ||
| Ligne 282 : | Ligne 278 : | ||
*<b>Le materiel de base:</b> un bec bunsen et un chalumeau au butane ou au propane, tout un lot de tube de verre de diametre 7mm (ils seront a usage unique!), une pince en metal pour maintenir des tubes dans la flamme, du fil de platine (pour les essais a la perle). | *<b>Le materiel de base:</b> un bec bunsen et un chalumeau au butane ou au propane, tout un lot de tube de verre de diametre 7mm (ils seront a usage unique!), une pince en metal pour maintenir des tubes dans la flamme, du fil de platine (pour les essais a la perle). | ||
| − | *<b>Les produits chimiques:</b> acide chlorhydrique (30%), nitrate de cobalt (solution a 10%), borax ( | + | *<b>Les produits chimiques:</b> acide chlorhydrique (30%), nitrate de cobalt (solution a 10%), borax (Na<sub>2</sub>B<sub>4</sub>O<sub>7</sub>.10H<sub>2</sub>O), sel de phosphore (=phosphate), acide sodoammoniacal (quelqun connait le nom en usage pour ce produit?), eau de chaux, ammoniaque (20-30%). Et a noter que pour le test d'hépar sur charbon il faut de l'hydroxyde de sodium anhydre (en pastilles) et une lamelle d'argent. |
| − | Et a noter que pour le test d'hépar sur charbon il faut de l'hydroxyde de sodium anhydre (en pastilles) et une lamelle d'argent. | ||
<hr> | <hr> | ||
Version du 24 novembre 2009 à 21:16
Article compilé à partir des informations collectées dans divers fils de discussion de Géoforum.
Un minéral se caractérise par ses propriétés physico-chimiques, sa dureté (classée sur l'échelle de Mohs de 0 à 10) et sa formule chimique, les variations admises dans la composition font que le minéralogiste considère volontiers les minéraux comme des espèces minérales, se caractérisant certes par leurs propriétés physiques (les plus « visibles » étant la symétrie, la couleur, la dureté, l'éclat, la trace et l'indice de réfraction) et chimiques, mais ne pouvant se confondre avec les éléments ou avec les composés chimiques du chimiste.
Sommaire
- 1 AIDE A LA DETERMINATION DES MINERAUX
- 1.1 La Dureté
- 1.2 La Densité
- 1.3 Couplage de la Densité et de la Dureté
- 1.4 La Trace
- 1.5 Le Clivage et la Cassure
- 1.6 La Couleur
- 1.7 La Transparence
- 1.8 L'éclat
- 1.9 La Morphologie
- 1.10 La réactivité aux acides, aux bases et à l’eau
- 1.11 Les divers ( luminescence, fluorescence, radioactivité, … )
- 1.12 Les analyses chimiques qualitatives
- 1.13 La couleur de la flamme
- 1.14 Fusibilité des minéraux
- 2 CLÉ de DÉTERMINATION
AIDE A LA DETERMINATION DES MINERAUX
Il faut noter qu’un certain nombre de tests sont destructeurs pour le minéral à identifier, si l’échantillon est limité il est donc recommandé de n’avoir recours à ces tests qu’en dernier ressort et sur la partie de l’échantillon qui présente le moins d’intérêt minéralogique.
Un minéral se détermine grâce à un certain nombre de propriétés, plus ou moins simples à identifier. Ces propriétés sont les suivantes :
La Dureté
Pour paraphraser un célèbre jeu, on pourrait appeler ça le "Qui raye Qui". La dureté est une valeur relative, comprise sur une échelle allant de 0 à 10, qui va mesurer la résistance d'un minéral à la rayure, à l'abrasion (usure), ou à la pénétration. C'est un des plus importants paramètres physiques des minéraux. Il permet souvent d'identifier rapidement un minéral (avec la prise en compte d'autres facteurs). L'échelle la plus souvent utilisée est celle de Mohs (1822), qui donne une graduation de dureté de 1 à 10 avec 10 minéraux types.
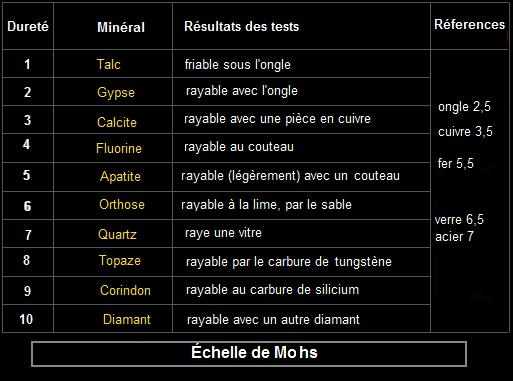
- Il suffit d'avoir des étalons de dureté connue, et d'essayer de les rayer avec le minéral à identifier. Il y a 4 étalons assez simples et pratiques : l'ongle (2 à 2,5), la pièce en cuivre (3,5), la lame de couteau (5,5), et la lame de verre (vers 6,5). Ce qui raye le verre a une dureté supérieure à 6,5 (quartz, corindon, diamant…), ce qui est rayé par l'ongle a une dureté inférieure à 2,5 (d’où les informations dans le tableau ci-dessus).
Il faut bien faire attention, lorsque l’on pratique ces tests, de ne pas forcer : la rayure doit se faire sans que l’on exerce de pression importante. - Utiliser le verre d'une fenêtre. Rayer le verre sur deux bons centimetres, en appuyant bien, et en utilisant pour ce faire une arête ou un angle vif de l'échantillon. Ensuite, verifier qu'il s'agit bien d'une rayure (et non d'une simple trace) : essuyer la rayure en la frottant avec le doigt humide : elle ne doit pas disparaitre ; gratter la rayure du bout de l'ongle : ça devrait accrocher un peu.
Chaque minéral type raye le précédent et est rayé par le suivant. Ainsi, si un minéral (dont on cherche à établir la dureté), raye l'orthose et est rayé par le quartz, alors sa dureté est d'environ 6,5. Dans les tests, il faut prendre un morceau en pointe pour essayer de rayer une surface test.
voir aussi à Liste minéraux par dureté
La Densité
Il suffit de prendre la pièce en main. Il s'avère que notre corps, et en particulier notre main, semble réglée sur la densité de la croûte terrestre (moyenne de 2,6). L'idéal est d'avoir un échantillon de 4 ou 5 cm (un peu plus petit que le poing). Pour cette même taille, certains vous paraîtrons "lourds" (le terme exacte étant "dense", c'est le cas typiquement de la barytine, la galène…), d'autres "légers", et enfin certains "moyens". Bien sûr, la densité se calcule aussi, sur une échelle de 1 à 20 :
- Minéraux légers (1 - 2)
- moyennement lourds (2 - 4)
- lourds (4 - 6)
- très lourds (6 - 20)
- Méthode de laboratoire :
Pour calculer la densité d'un minéral, on mesure sa masse (son " poids ") dans l'air (Mair); On mesure sa masse (son " poids ") lorsqu'il est immergé dans une colonne d'eau distillée (Meau) D = Mair / (Mair - Meau)
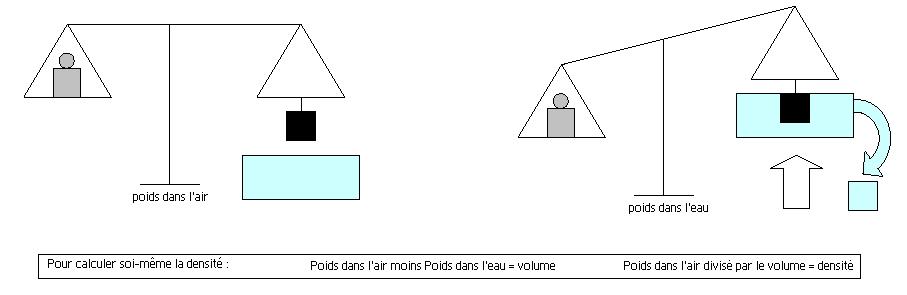
Attention la densité pour un même minéral peut varier beaucoup en fonction de la présence possible d'inclusions, ou de l'état d'oxydation. Il existe d’autres méthodes de calcul, qui sont liées aux masses volumiques des composés chimiques présents dans l’échantillon à peser, cette masse volumique étant elle-même liée à la masse atomique de l’ensemble des atomes constituant l’échantillon. Il est donc évident que certains calculs sont plus théoriques que pratiques.
- Autre méthode plus facile à mettre en œuvre :

Calcul de la densité des échantillons de taille moyenne, même avec pèse-lettre ou balance de cuisine (meilleure est la balance, mieux c'est !).
1) Mettre un récipient d'eau sur une balance et faire la tare (eau distillée uniquement pour les puristes)
2) Immerger totalement l'échantillon sans toucher le fond ni le bord (mesure M1)
3) Laisser couler l'échantillon (mesure M2)
Densité = M2 / M1
Ou, si la tare n'est pas utilisée
1) Balance à 0, mettre un récipient d'eau sur une balance (mesure M0)
2) Immerger totalement l'échantillon sans toucher le fond ni le bord (mesure M1)
3) Laisser couler l'échantillon (mesure M2)
Densité = (M2 - M0) / (M1 - M0)
Rq1 : la mesure M1 affichée par la balance est également le volume de l'échantillon en cm3
Rq2 : Pour les échantillons poreux, bien s'assurer que les bulles d'air sont parties avant de faire les mesures
Rq3 : la pierre peut être tenue par une ficelle (petites pierres) mais un filet est plus pratique pour les plus grosses pierres.
voir aussi à Liste minéraux par densité
Couplage de la Densité et de la Dureté
La mesure de la densité et de la dureté peuvent être des alliés très puissants en terme de détermination si ces deux grandeurs sont "couplées" dans un graphe. En effet la connaissance de ces deux données réduit considérablement le nombre de candidats possibles, les minéraux n'appartenant qu'à des domaines restreints de densité et de dureté. La figure ci-dessous présente les gammes de densité et de dureté d'un ensemble de minéraux communs.
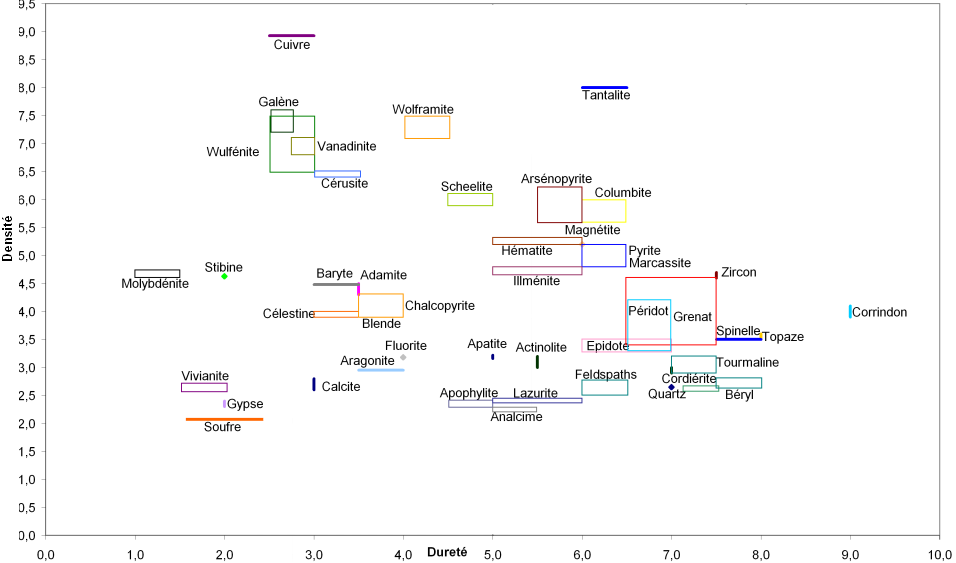
L'utilisation de cette figure est simple. après mesure de la densité et de la dureté, vous reportez ces deux valeurs dans le graphe. Si le point correspondant se trouve dans un rectangle coloré, ou relativement proche d'une des lignes ou des points colorés. Vous disposerez alors d'un ensemble de candidats restreints. Vous les discriminerez ensuite à l'aide des propriétés respectives de chaque minéral potentiel.
La Trace
Mystérieux test que celui-ci. Il se base sur la couleur que la poudre du minéral laissera sur l'envers d'une plaque de porcelaine (le coté granuleux, non verni). Pour exemple, prenons une hématite. Beau minéral gris/noir… sa trace sera systématiquement… rouge sang ; alors que la goethite, mineral noir aussi, laissera un trait jaune ocre... Pour les minéraux plus durs que la porcelaine, il faut les réduire en poudre au marteau et frotter la poudre sur la porcelaine. Alors que les minéraux les plus tendres (graphite, molybdénite, etc.) seront frottés directement sur une feuille de papier (genre " Canson "). La couleur de la trace n'est pas forcément la même que celle du minéral, comme l’exemple de l’hématite et de la goethite le prouve.

Le Clivage et la Cassure
- Le clivage est un plan de cassure privilégié dont l'orientation est dictée par la structure cristalline… ". C’est donc la propriété qu'ont certains minéraux de se casser suivant des directions prédéterminées par la structure atomique du minéral. En fonction des minéraux, il peut y avoir une, deux, ou trois directions de clivage. On parle alors de plans de clivage et du nombre de plans de clivage. On estime la qualité du clivage suivant 6 niveaux :
- Excellent, le minéral se clive en fines lamelles dans un sens. (ex : muscovite...)
- Très bon, le minéral se clive en formes régulières délimitées. (ex : galène en cubes, calcite en rhombohèdres...)
- Bon, les plans de clivage ne sont pas parfaitement droits (ex : orthose...)
- Imparfait, les surfaces de clivage sont irrégulières. (ex : apatite...)
- Très imparfait, on ne voit pas bien le clivage,
- Mauvais, il n'y a pas réellement de clivage (ex : pyrite...) on parle alors de cassure
- Certains minéraux, à défaut de montrer des clivages, peuvent posséder des plans de séparation…
(Traduit de l'anglais on trouve : parfait, imparfait, bon, distinct, indistinct, et mauvais.)
- La cassure correspond à une fracture qui n'est pas prédéfinie dans le minéral. C'est le cas du quartz par exemple. La cassure n'ayant pas de plan de faiblesse à exploiter, pas de forme géométrique définie. Le quartz présente une cassure, dite conchoïdale, assez facilement reconnaissable. Ensuite pour la cassure il faut différencier :
- la cassure conchoïdale qui forme toujours une esquille (de taille très variable suivant le choc reçu ...) ressemblant à un coquillage (genre palourde)
- la cassure irrégulière (ex : pyrite...)
- la cassure écailleuse ... qui est intermédiaire des deux précédentes.
Enfin il faut noter que certains minéraux, tel le gypse, se clivent selon un plan et se cassent s'ils sont frappés hors de leur plan de clivage.
Plus le clivage est bon, plus il est facile de casser l'échantillon.
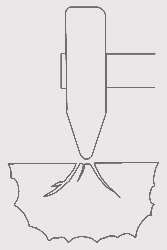 La cassure est surtout identifiée par le fait qu’elle est conchoïdale ou pas.
La cassure est surtout identifiée par le fait qu’elle est conchoïdale ou pas.voir aussi à Liste minéraux par clivage
La Couleur
Ça peut paraître bateau, mais bon, ce qui nous saute aux yeux va forcément constituer un indice qui va être prépondérant. Cependant, " l'habit ne fait pas le moine ", est un adage qui s'applique particulièrement bien dans le cas qui nous intéresse. Bien que les minéraux aient en général une couleur principale qui les caractérise, il faut savoir que les magies de la chimie et de la physique nous réservent des surprises. La couleur est un caractère important mais pas toujours fiable. En effet beaucoup de minéraux peuvent avoir un grand nombre de couleurs (ex: les variétés de quartz). Cependant pour beaucoup d'autres minéraux la couleur est caractéristique : l'albite est blanche, l'azurite est bleue, la chlorite est généralement verte (elle peut avoir d'autres couleurs dans certains cas particuliers ), etc... On répartit les minéraux en 4 groupes suivant l'origine de la couleur :
- Achromatiques (incolores), la lumière qui traverse les cristaux n'est pas modifiée (ex : cristal de roche)
- Idiochromatiques (colorés), une partie du spectre lumineux est absorbée, la couleur du cristal est typique des atomes qu'il contient, des métaux dans la structure cristalline (ex: azurite (Cu : cuivre) = bleu, rhodonite (Mn : manganèse) = rose, autunite (U : uranium) = jaune, etc...)
- Allochromatiques (couleur du fait des inclusions en traces), le minéral contient une faible proportion d'atomes étrangers (impuretés, inclusions...) et cela colore le cristal (ex : variétés de quartz)
- Pseudochromatiques (apparemment colorés), des fractures, plans de clivage, courbes, plis dans le réseau du cristal provoquent des effets colorés (irisation, scintillement, opalisation) se produisent dans le cristal par suite de réflexion ou de réfraction.
La Transparence
C'est le fait de laisser passer la lumière ou non. On distingue les niveaux de transparence suivants :
- Transparent, même avec une grande épaisseur (ex : cristal de roche...)
- Semi-transparent, la vision est trouble à travers (ex : fluorine, calcite...)
- Translucide, la lumière traverse, mais c'est tout (ex : calcédoine, agate...)
- Non-transparent, la lumière ne passe pas, mais il est translucide en coupe mince (ex : actinote...)
- Opaque, la lumière ne passe pas du tout (ex : pyrite, galène...)
L'éclat
L'éclat est la perception visuelle de la manière dont un minéral réfléchit la lumière. On parle d'éclat métallique, vitreux, adamantin, résineux, soyeux, terreux… C'est un déterminatif qui est très relatif, selon que le minéral soit bien cristallisé, ou pas, frais ou altéré, et en fonction de sa taille. C'est la lumière qui est réfléchie par le minéral. Un même minéral n'a pas toujours le même éclat suivant sa morphologie. (voir ci-dessous) Les différents éclats sont :
- Métalliques:
- Métallique, c'est un éclat fort bien marqué sur les faces cristallines et les plans de clivage. Caractérise surtout les minéraux opaques (ex : pyrite, galène...)
- Semi-métallique (sub-métallique), c'est l'éclat de certains minéraux transparents ou semi-transparents. (ex : sphalérite, cassitérite...)
- Non-métalliques:
- Adamantin, c'est l'éclat fort des minéraux translucides à transparents (ex : diamant...)
- Vitreux, éclat qui rappelle le verre (ex : quartz...)
- Gras à résineux, comme celui du talc, du soufre...
- Nacré, caractéristique des minéraux transparents à semi-transparents (ex :calcédoine...) et ayant un bon clivage en feuillets. (ex : gypse...)
- Soyeux, typique des minéraux fibreux. (ex : trémolite, gypse fibreux...)
- Mat, éclat faible de minéraux surtout terreux. (ex : kaolinite, montmorillonite...)
La Morphologie
C'est la forme des cristaux, il est important de noter qu'un même minéral peut avoir beaucoup de formes différentes, par exemple la calcite. On distingue :
- les formes cristallines
- Cristaux idiomorphes : que des faces cristallines.
- Cristaux hyidiomorphes : ils ont des faces cristallines bien visibles.
- Cristaux xénomorphes : ils sont déformés car leur croissance a été limité par la présence d'autres cristaux (en fait ils remplissent les vides entre les minéraux bien formés).
- Cristaux à forme isométrique : ils ont une symétrie centrale.
- Cristaux à forme allongée dans un sens : minéraux en colonnes, aiguilles, fibreux, capillaires.
- Cristaux à forme allongée dans 2 sens : en tablettes, disques, feuillets, écailles.
- les agrégats :
- Agrégats cristallins grenus, même minéraux associés en petits grains.
- Agrégats cristallins aciculaires, cristaux rayonnants.
- Agrégats cristallins en lamelles, comme pour les micas.
- Agrégats cristallins oolithiques, comme un assemblage de petites billes.
- Agrégats cristallins dendritiques, typiques de l'or, de l'argent, ou du cuivre.
- Agrégats cristallins poreux, mousseux, spongieux.
- Agrégats cristallins en stalactites.
- Voir aussi : Cristal paragraphe agrégats.
- les Pseudomorphoses : des minéraux se forment en remplacement d'autres apparus avant, mais les nouveaux, bien que différents, conservent la forme (ou pseudo-forme) des anciens minéraux. (Voir : Pseudomorphoses et Les périmorphoses)
La forme est donc un déterminant important, mais il faut faire très attention, car un même minéral va pouvoir prendre plusieurs formes en fonction des conditions de sa mise en place.
voir aussi à Cristal
La réactivité aux acides, aux bases et à l’eau
Produit indispensable : un peu d'acide chlorhydrique (HCl), ou au pire du vinaigre blanc et une pipette. La plupart des carbonates (voir : V CARBONATES) sont réactifs à l'acide. La réaction au vinaigre est moins évidente, mais elle est quand même visible. La calcite, principale représentante de cette classe, émet une légère effervescence en présence de quelques gouttes d'acide.

Il existe des variantes au test, comme l'acide à chaud pour la dolomite, qui est un peu moins réactive que sa cousine calcite.
D'autres minéraux ne font pas effervescence, mais sont solubles dans l'acide, ou même dans l'eau (la halite par exemple).
voir à : Liste minéraux par solubilité.
ATTENTION : bien que nécessaire dans des concentrations qui ne sont pas énormes, l'acide chlorhydrique reste un produit actif. A manipuler avec les précautions d'usage, dans un cadre aéré !!
Sans plus s’étendre sur le sujet, un certain nombre de minéraux sont réactifs à divers acides, diverses bases, et des minéraux comme la halite ( sel gemme ) sont réactif à l’eau. voir aussi à Comment nettoyer les minéraux ?.
 Attention danger !
Attention danger !
Les acides, bases et autres produits chimiques, concentrés peuvent provoquer des brûlures sur la peau et les muqueuses, l’utilisation doit toujours se faire par des personnes formées et équipées (blouse, gants, lunettes), et sous hotte.
Les divers ( luminescence, fluorescence, radioactivité, … )
- La Luminescence est l'émission, ou la réémission, de rayonnement lumineux par des minéraux. Il existe plusieurs formes de luminescences :
- La triboluminescence : venant de frottements entre minéraux, ou de chocs portés sur certains minéraux ;
- La thermoluminescence : certains minéraux sont luminescents quand ils sont chauffés ;
- La photoluminescence: luminescence qui se produit quand on éclaire certains minéraux avec une source de lumière visible ou invisible, (par exemple de la "lumière noire" des U.V. ) ;
- La phosphorescence : est une forme de luminescence qui se poursuit - durant un temps plus ou moins long - après que la source ayant causé l'une des luminescences ci-avant exposées ait été supprimée.
voir aussi à Luminescence et minéraux et aussi à Sensibilité des minéraux.
- La radioactivité se détecte grâce à un compteur Geiger ou à un dosimètre.
Minéraux radio-actifs : allanite, autunite, bétafite, brannérite, calcumorlite, carnotite, chalcolite, curite, fergusonite, gadolinite, gummite, héliodore, kasolite, lodévite, microlite, orthite, pechblende, phosphuranylite, phurcalite, pyrochlore, renardite, sabugalite, sklodowskite, swarzite, thorianite, thorite, torbernite, tyuyamunite, uraninite, uranite, uranophane, uranopilite, uranotile, uranospinite, vanularite, wolendorfite, zircon...
- Le magnétisme, ou son absence, est assez simple à trouver, grâce à un aimant.
- Autres:
- L'odeur : certains minéraux émettent une odeur caractéristique : le soufre a une odeur particulière. Il en va de même pour l'arsénopyrite (ou Mispickel pour les nostalgiques) qui, à la cassure fraîche, présente une odeur d'ail.
- le goût : d’autres ont un goût caractéristique (halite, potasse). Il faut tout de même faire attention à ce que l’on met sur la langue, certain minéraux sont toxiques, ce genre de test est donc à utiliser avec discernement.
- solubilité : certains minéraux sont solubles dans l'eau (ex: halite ou sel gemme). D'autres se dissolvent dans un acide ou une base (carbonates dans HCl (l'acide chlorhydrique), avec ou sans effervescence). voir aussi à Comment nettoyer les minéraux ?.
Les analyses chimiques qualitatives
Remarque: on abordera pas ici l'analyse chimique quantitative, autrement plus complexe et necessitant un materiel bien plus pointu!
Tout d'abord, il faut distinger l'analyse qualitative par voie seche, et l'analyse qualitative par voie humide. A noter que dans un cas comme dans l'autre il est important de pratiquer l'analyse sur un fragment de mineral propre (le petit fragment analysé ne doit etre constitué que du mineral a identifier, et ne pas inclure d'autres mineralisations, par exemple il ne doit pas presenter d'encroutement d'oxydes en surface car cela risquerai fort de fausser completement les tests).
L'analyse qualitative par voie humide:
L'analyse par voie humide donne des resultats absolument fiables mais necessite aussi un certain nombre de reactifs chimiques de laboratoire (et certains sont dangereux).
Elle consiste grossierement a ajouter des reactifs chimiques a la matiere minerale a analyser dans le but d'observer des reactions caracteristiques (precipités colorés...). Pour cela, le mineral est generalement mis en solution dans un acide fort au prealable (HNO3 concentré le plus souvent).
Il existe ainsi des reactions caracteristiques pour de nombreux elements (ex: Fer, Bismuth, Cuivre...), ou bien pour des groupements anioniques donnés (carbonates, phosphates...)
- Le materiel de base: un peu de verrerie (un filtre conique en verre, un becher en verre Pyrex, un agitateur en verre), du papier filtre de chimie, une pince pour manipuler la verrerie a chaud, etc...
Ne pas oublier une paire de gants de chimie et surtout des lunettes de protection pour proteger vos yeux lorsque vous manipulerez des produits fortement corrosifs!!! (une blouse de chimie en cotton est aussi recommandable)
- Les produits chimiques de base: acide nitrique concentré (68%), acide chlorhydrique (a 30 %) et acide sulfurique (a 30 a 37%), ammoniaque (20-30%), et hydroxide de sodium (30%)Ces produits se trouvent tous dans les magasin de bricolage et quincailleries du style "casto-brico-truc", a l'exception de l'acide nitrique qui ne peut etre obtenu que par le biais de fournisseurs specialisés en produits chimiques et dont la vente est surveillée (pour des raisons...explosives!).
A noter que l'acide nitrique est tres dangereux, d'une part parcequ'il est extremement corrosif, mais aussi parcequ'il peut engendrer des incendies et de violentes explosions par simple contact avec certaines substances chimiques (notemment les substances organiques, comme par exemple les solvants organiques et les hydrocarbures, entre autres)
- Les reactifs chimiques (pour la caracterisation specifique d'un element ou d'un groupement): ceux-ci dependront des elements/anions que l'on souhaitera mettre en evidence, on peut donc se constituer peu a peu tout un jeu de reactif variés (je recommande au amateurs d'eviter de manipuler ou stocker des reactifs chimiques hautement toxiques, lesquels peuvent generalement etre remplacés par d'autres produits un peu moins dangereux!)
- Petit rappel de base concernant les produits chimiques: certains produits chimiques sont incompatibles, ce qui signifie que mis en contact ils peuvent provoquer l'emanation de vapeurs toxiques, declencher une reaction violente incontrolée, un incendie ou une explosion.Cela implique d'une part qu'on ne peut pas melanger n'importe quoi avec n'importe quoi, mais aussi, et c'est tres important, qu'on ne peut pas stocker n'importe quel produit a coté de n'importe quel produit!
Par exemple on ne stocke pas les bases fortes concentrées a proximité des acides forts concentrés, on ne stocke pas des acides a proximité de javel, et dans le meme ordre d'idée on ne stocke en aucun cas l'acide nitrique concentré a proximité de matieres organiques tels que les hydrocarbures et les solvants organiques!
A chacun de bien se renseigner sur les incompatibilités chimiques de chaque produit en sa possession.
L'analyse qualitative par voie seche:
Celle-ci demande des moyens plus reduits que l'analyse par voie humide mais elle n'est pas entierement fiable (un peu plus approximative).
On pourra distinguer differents tests appartenant a cette categorie:
- determination de la fusibilité et de la couleur de la flamme: on observe la couleur de la flamme pendant le chauffage, ainsi que la couleur de la flamme apres avoir trempé brievement l'echantillon dans HCl. On observe si le mineral fond facilement, moyennement, difficilement ou pas du tout. On observe l'eventuel residu de fusion obtenu, son aspect et ses proprietes particulieres s'il en est. (voir chapitres spécifiques ci après)
- chauffage du mineral en tube ouvert, et en tube fermé: on observe la volatilité, la fusibilité, les eclaboussures ou eclatements, les changements de couleur, la luminescence, les degagement gazeux (eventuellement odorants), les depots de residus, etc......
- chauffage du mineral sur charbon, dans la flamme oxydante, dans la flamme reductrice on observe la formation d'un voile sur le charbon, la formation d'un residu de fusion, un depot, une odeur caracteristique...
- deux autres reactions de chauffage sur charbon sont la reaction d'hépar utilisée pour detecter la presence de soufre, et la reaction avec solution de nitrate de cobalt sur charbon utilisée pour les mineraux ne fondant pas au chalumeau et de couleur claire.
- essais a la perle de borax, et essai a la perle de sel de phosphore (dans les deux cas on pratique un essai dans la flamme oxydante d'une part, et un essai dans la flamme reductrice d'autre part) on observe la couleur de la perle obtenue en flamme oxydante, et al couleur de la perle obtenue en flamme reductrice
- Le materiel de base: un bec bunsen et un chalumeau au butane ou au propane, tout un lot de tube de verre de diametre 7mm (ils seront a usage unique!), une pince en metal pour maintenir des tubes dans la flamme, du fil de platine (pour les essais a la perle).
- Les produits chimiques: acide chlorhydrique (30%), nitrate de cobalt (solution a 10%), borax (Na2B4O7.10H2O), sel de phosphore (=phosphate), acide sodoammoniacal (quelqun connait le nom en usage pour ce produit?), eau de chaux, ammoniaque (20-30%). Et a noter que pour le test d'hépar sur charbon il faut de l'hydroxyde de sodium anhydre (en pastilles) et une lamelle d'argent.
La couleur de la flamme
Permet de détecter la présence dans l'échantillon de certains éléments chimiques !
On utilise un morceau du minéral mince, aux arêtes vives. On le saisit avec une pince, on le met dans la partie non éclairante de la flamme du bec après avoir trempé l'échantillon brièvement dans HCl. Ne pas y plonger également les pinces (qui peuvent être souillées par autre chose) et éviter de toucher l'échantillon avec les doigts avant la manip car le sel de la peau peut troubler le résultat. Il vaut mieux, donc, utiliser un morceau frais du minéral pour éviter les traces étrangères possibles à sa surface !
voir aussi à FORMULES CHIMIQUES
| ____________PAR ÉLÉMENTS à RECHERCHER___________
As : faiblement azur Ba : jaune-vert Ca : orange à rouge brique Cu : émeraude CuCl2) : azur K : violet clair Li : rouge carmin Mn : verte Mo : jaune-vert Na : jaune vif Pb : gris-vert à bleuâtre Rb : bleu Sb : très faible bleu-vert Se : bleu Sr : carmin Te : verdâtre (pour les oxydes) Tl : verte (couleur disparaissant vite) Zn : verte (à bleu) |
____________PAR COULEUR de la FLAMME___________
jaune vif : Na jaune-vert : Mo jaune-vert : Ba verte : Ti (couleur disparaissant vite) verte : Mn verte (à bleu) : Zn verdâtre : Te (pour les oxydes) émeraude : Cu gris-vert à bleuâtre : Pb bleu-vert très faible : Sb bleu : Se bleu : Rb azur : CuCl2 faiblement azur : As violet clair : K carmin : Sr rouge-carmin : Li orange à rouge brique : Ca |
Fusibilité des minéraux
- avec une bougie : anglésite, antimoine natif, bismuth natif, bismuthinite, borax, cryolite, gonnardite, mésolite, natrolite, natronite, nitratite, phosgénite, stibine, ulexite...
- au chalumeau facilement : acmite, actinote, adamite, aégyrine, allanite, almandin, amblygonite, andradite, ankérite, annabergite, antimoine natif, apatite, apophyllite, argent natif, argentite, arsénopyrite, astrophyllite, atacamite, autunite, axinite, azurite, babingtonite, bénitoïte, béryllonite, biotite, boléïte, boracite, bornite, boulangérite, bournonite, brochantite, bromargyrite, bronzite, calcédoine, cancrinite, chabazite, chalcocite, chalcophyllite, chalcopyrite, chalcotrichite, chessylite, chlorargyrite, chromite, clinozoïsite, colémanite, copiapite, covelline, crocidolite, crocoïte, cuivre natif, cuprite, cyanotrichite, damburite, datolite, descloïzite, dipyre, dravite, dufrénite, elbaïte, emplectite, énargite, épidote, epsomite, érubescite, érythrite, ferberite, fluorite, galène, glaubérite, glauconite, glaucophane, grossulaire, halite, halotrichite, haüyne, hédenbergite, hessonite, hétérosite, heulandite, hubnérite, huréaulite, hyalite, idocrase, ilménite, jadéite, jamésonite, kunsite, lapis lazuli, laumontite, lauwsonite, lazurite, léadhilite, lépidolite, leucite, libéthénit, linarite, liroconite, malachite, marcasite, marialite, méionite, milarite, millérite, mimétite, mispickel, néphéline, néphrite, neptunite, nickéline, olivénite, or natif, orpiment, pectolite, pharmacolite, phillipsite, pistchite, plumosite, préhnite, proustite, purpurite, pyrargyrite, pyrite, pyromorphite, pyrrhotite, réalgar, rhodonite, riébeckite, rubellite, scapolite, scolécite, scorodite, skuttérudite, sodalite, soufre natif, spessartite, sphène, spodumène, stilbite, strontianite, sylvanite, sylvite, tanzanite, tennantite, ténorite, thénardite, thomsonite, thulite, titanite, torbernite, tourmaline, trémolite, uranite, uvite, vanadinite, vésuvianite, vivianite, wernérite, withérite, wolframite, wollastonite, wulfénite, zinnwaldite zoïsite...
- au chalumeau difficilement : adulaire, albite, andésite, anorthite, anthophyllite, antigorite, augite, bixbyite, cummingtonite, édénite, gédrite, grunérite, hornblende, hypersthène, microlite, muscovite, oligoclase, pargasite, sénarmontite, valentinite...
- se sublime : (Propriété de passer d'un état solide a l'état gazeux.) arsenic natif, arsénolite, calomel, claudetite, mercure natif, salmiac, tellurite...
CLÉ de DÉTERMINATION
Un lien utile : http://www.rockhounds.com/rockshop/mineral_id/#Key
Et en rappel : Liste minéraux par dureté Liste minéraux par densité Liste minéraux par clivage liste minéraux par sensibilité Liste minéraux par solubilité Liste minéraux par fusibilité Liste minéraux par système cristallin Liste minéraux par classes Liste minéraux avec leur formule chimique
Retour à Lexique des termes employés en minéralogie