Les classifications en minéralogie : Différence entre versions
m |
|||
| (7 révisions intermédiaires par 4 utilisateurs non affichées) | |||
| Ligne 1 : | Ligne 1 : | ||
| − | < | + | __NOEDITSECTION__ |
| + | <h1> De la composition chimique aux classes minérales </h1><br> | ||
| − | < | + | <h2> Approche de la classification de Nickel-Strunz 10ème édition </h2> |
| − | L’étude des compositions chimiques des minéraux permet de créer d’autres façons de les ranger en plus de leur système cristallin. Pour introduire et développer le concept de classe minérale, nous ferons donc un peu de chimie et comme nous l’avons toujours fait jusqu’à maintenant, prenons deux cas simples : le soufre natif et la pyrite. Le premier est exclusivement composé de soufre : S, le second est composé de fer et de soufre : | + | L’étude des compositions chimiques des [[minéraux]] permet de créer d’autres façons de les ranger en plus de leur [[système cristallin]]. Pour introduire et développer le concept de [[classe]] minérale, nous ferons donc un peu de [[chimie]] et comme nous l’avons toujours fait jusqu’à maintenant, prenons deux cas simples : le [[soufre]] natif et la [[pyrite]]. Le premier est exclusivement composé de soufre : S, le second est composé de [[fer]] et de soufre : FeS<sub>2</sub>. On peut donc trouver au moins deux classes générales de minéraux : les minéraux « simples » et les minéraux composés. En minéralogie, la classe des minéraux simples est appelée « Éléments natifs ». Par contre, il existe de nombreuses façons d’obtenir des minéraux composés. Étudions le cas du fer dans différents minéraux :<br> |
<center>[[image:Tableau1.PNG]]</center> | <center>[[image:Tableau1.PNG]]</center> | ||
| − | On peut voir dans le tableau, des compositions chimiques relativement complexes où le fer est associé à 1, 2 voire 3 autres | + | On peut voir dans le tableau, des compositions chimiques relativement complexes où le fer est associé à 1, 2 voire 3 autres [[atome]]s. Mais cela ne suffit pas à établir une classification valable, il faut aller un peu plus loin en chimie. Nous allons donc introduire un concept nouveau : les [[ion]]s.<br> |
| − | Qu’est-ce qu’un ion ? Nous sommes familiers des atomes avec lesquels nous jouons depuis le début. Les atomes sont constitués d’un centre appelé noyau, avec une charge globale positive et d’un cortège d’électrons avec une charge globale négative. Comme la nature est bien faite, le nombre de charges négatives portées par les électrons compense le nombre de charges positives du noyau ; on parle alors de neutralité de l’atome. Par exemple, le fer possède 26 électrons pour compenser les 26 charges positives de son noyau. Mais suivant les cas, il peut en perdre deux ou trois, et se retrouver avec une charge globale positive : c’est une oxydation. On parle alors de | + | Qu’est-ce qu’un ion ? Nous sommes familiers des atomes avec lesquels nous jouons depuis le début. Les atomes sont constitués d’un centre appelé noyau, avec une charge globale positive et d’un cortège d’électrons avec une charge globale négative. Comme la nature est bien faite, le nombre de charges négatives portées par les électrons compense le nombre de charges positives du noyau ; on parle alors de neutralité de l’atome. Par exemple, le fer possède 26 électrons pour compenser les 26 charges positives de son noyau. Mais suivant les cas, il peut en perdre deux ou trois, et se retrouver avec une charge globale positive : c’est une [[oxydation]]. On parle alors de [[cation]]s et dans le cas du fer on le notera Fe<sup>2+</sup> ou Fe<sup>3+</sup> suivant qu’il ait perdu 2 ou 3 électrons.<br> |
| − | Le cas contraire peut aussi se produire c'est-à-dire un gain d’électron. Le chlore possède 17 électrons pour compenser les 17 charges positives de son noyau et il arrive fréquemment que ce dernier gagne un électron, c’est une réduction. Sa charge globale devient négative, on obtient ce que l’on appelle un anion que l’on notera pour le cas du chlore Cl-. Ainsi à partir de ces deux exemples, on appelle ion, toute molécule ou tout atome ayant perdu ou gagné des électrons. Cet objet maintenant introduit va nous permettre d’aller plus loin dans notre étude. Complétons le tableau précédent avec cette nouvelle notion de cations et d’anions.<br> | + | Le cas contraire peut aussi se produire c'est-à-dire un gain d’électron. Le [[chlore]] possède 17 électrons pour compenser les 17 charges positives de son noyau et il arrive fréquemment que ce dernier gagne un électron, c’est une [[réduction]]. Sa charge globale devient négative, on obtient ce que l’on appelle un [[anion]] que l’on notera pour le cas du chlore Cl<sup>-</sup>. Ainsi à partir de ces deux exemples, on appelle ion, toute molécule ou tout atome ayant perdu ou gagné des électrons. Cet objet maintenant introduit va nous permettre d’aller plus loin dans notre étude. Complétons le tableau précédent avec cette nouvelle notion de cations et d’anions.<br> |
<center>[[image:Tableau2.PNG]]</center> | <center>[[image:Tableau2.PNG]]</center> | ||
| − | Ce tableau montre que l’on peut ranger les minéraux à partir des anions présents dans le cristal. Le nom des anions donnera le nom de la classe minérale. Ce type de classification où les anions sont utilisés pour créer une classe minérale, est plus judicieux qu’une classification par cation car souvent c’est l’anion qui va imposer la structure cristalline. Par exemple, les carbonates de magnésium ( | + | Ce tableau montre que l’on peut ranger les minéraux à partir des anions présents dans le [[cristal]]. Le nom des anions donnera le nom de la [[classe]] minérale. Ce type de classification où les anions sont utilisés pour créer une classe minérale, est plus judicieux qu’une classification par cation car souvent c’est l’anion qui va imposer la structure cristalline. Par exemple, les carbonates de [[magnésium]] (MgCO<sub>3</sub>, [[magnésite]] ), de [[calcium]] (CaCO<sub>3</sub>, [[Calcite]] ) et de [[cobalt]] (CoCO<sub>3</sub>, [[sphaérocobaltite]] ) ont la même [[structure]] cristalline, il est donc logique de les classer ensemble en plus de leur anion CO<sub>3</sub><sup>2-</sup> commun.<br> |
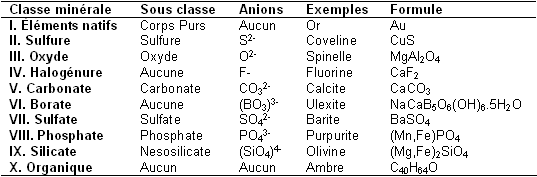
| − | Nous avons cité précédemment les éléments natifs. Maintenant nous pouvons ajouter les classes que nous avons trouvées dans le tableau. Un initié devrait se rendre compte qu’il manque trois classes : les halogénures, les borates et les minéraux organiques. Les halogénures sont issus de l’union entre un halogène et un cation. Les halogènes courants sont les suivants : Fluor F, Chlore Cl, Brome Br et | + | Nous avons cité précédemment les éléments natifs. Maintenant nous pouvons ajouter les classes que nous avons trouvées dans le tableau. Un initié devrait se rendre compte qu’il manque trois classes : les halogénures, les borates et les minéraux organiques. Les halogénures sont issus de l’union entre un halogène et un cation. Les halogènes courants sont les suivants : [[Fluor]] F, Chlore Cl, [[Brome]] Br et l’[[Iode]] I. Les deux minéraux les plus connus de la famille des halogénures sont la [[fluorine]] de formule CaF<sub>2</sub> et le sel de table appeler plus rigoureusement [[halite]] de formule NaCl. Les minéraux organiques sont eux essentiellement constitués d’[[oxygène]], de [[carbone]], d’[[azote]] et d’[[hydrogène]]. L’[[ambre]] est un minéral organique aussi connu que répandu. Les borates sont peu communs, il s’agit de l’union de l’anion (BO<sub>3</sub>)<sup>3-</sup> avec un ou des cations. L’un des borates les plus connus est l’[[ulexite]] encore appelée « la pierre télévision ». Le tableau qui suit récapitule toutes les classes minérales que nous avons trouvées ensemble.<br> |
<center>[[image:Tableau3.PNG]]</center> | <center>[[image:Tableau3.PNG]]</center> | ||
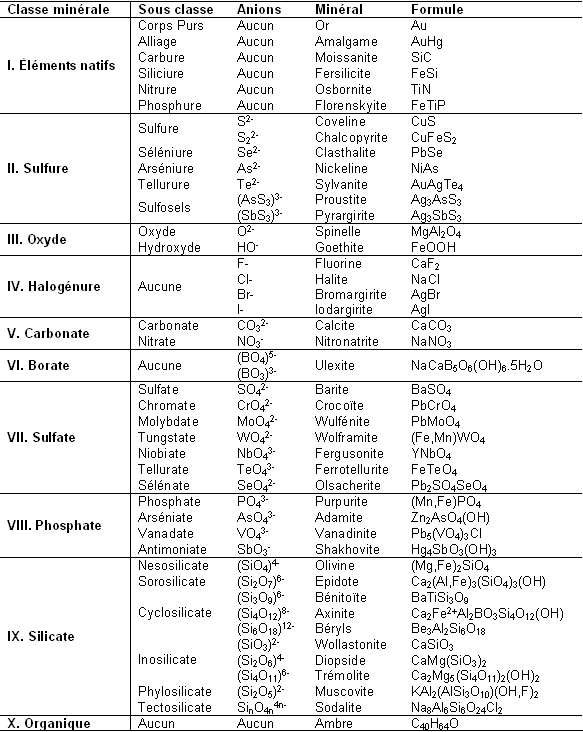
| − | Les | + | Les [[classe]]s minérales sont en fait bien plus complexes car le nombre d’anions existants est assez important. Ils rentrent cependant tous dans l’une des dix classes minérales que nous avons trouvées précédemment. Le tableau présent sur la page suivante résume les sous-classes présentes dans les classes principales, les anions associés et un minéral représentatif de la sous-classe. Ce tableau n’est ni exhaustif ni fondamental pour la suite de l’article. <br> |
<center>[[image:Tableau4.PNG]]</center> | <center>[[image:Tableau4.PNG]]</center> | ||
| − | Il y a d’autres classifications | + | Il y a d’autres classifications où l’ambre n’est pas considéré comme un minéral, comme dans les classifications de Hey 3ème édition et celle de Dana 8ème édition détaillées plus loin.<br> |
| − | < | + | <h2> La classification de Nickel-Strunz 10ème édition </h2> |
| − | Vous avez été initié à la classification de Nickel-Strunz dans la partie précédente. C’est cette classification que j’ai choisie de vous présenter en premier car c’est la plus utilisée dans les livres de minéralogie | + | Vous avez été initié à la classification de Nickel-Strunz dans la partie précédente. C’est cette classification que j’ai choisie de vous présenter en premier car c’est la plus utilisée dans les livres de minéralogie destinés aux passionnés. Cependant elle est plus complexe que cela. Je vous propose donc d’aller plus loin dans les détails de cette classification. <br> |
| − | Dans cette classification, tous les minéraux sont rangés dans 10 familles d’anions identifiées par un numéro de 1 à 10, nous l’avons déjà vu précédemment. Dans chaque famille on trouve des sous-familles constituées des anions qui ont des propriétés chimiques, géométriques ainsi qu’une charge similaires. Ces sous-familles sont identifiées par une lettre ajoutée au numéro de la famille principale. Enfin chaque sous-famille est subdivisée en fonction des cations, des autres anions associés, de groupements formulaires typiques etc. Pour identifier ces subdivisions une lettre supplémentaire est ajoutée à l’identifiant de la sous famille. Enfin les minéraux contenus dans ces dernières subdivisions reçoivent un numéro qui fait référence à un type structural.<br> | + | Dans cette classification, tous les minéraux sont rangés dans 10 familles d’anions identifiées par un numéro de 1 à 10, nous l’avons déjà vu précédemment. Dans chaque famille on trouve des sous-familles constituées des anions qui ont des propriétés chimiques, géométriques ainsi qu’une charge similaires. Ces sous-familles sont identifiées par une lettre ajoutée au numéro de la famille principale. Enfin chaque sous-famille est subdivisée en fonction des cations, des autres anions associés, de groupements formulaires typiques, etc. Pour identifier ces subdivisions une lettre supplémentaire est ajoutée à l’identifiant de la sous-famille. Enfin les minéraux contenus dans ces dernières subdivisions reçoivent un numéro qui fait référence à un type structural.<br> |
| − | Cela permet d’identifier chaque minéral par un numéro, par exemple la calcite a pour identifiant 5.AB.05. La calcite appartient à la famille 5 du groupe 5.AB des carbonates d’alcalino-terreux et autres cations divalents et le chiffre 05 désigne le type structural. Tous les minéraux d’un même groupe et du même numéro final sont de même type structural. Le numéro de type structural a une particularité : c’est toujours un multiple de 5.<br> | + | Cela permet d’identifier chaque minéral par un numéro, par exemple la [[calcite]] a pour identifiant 5.AB.05. La calcite appartient à la famille 5 du groupe 5.AB des carbonates d’alcalino-terreux et autres cations divalents et le chiffre 05 désigne le type structural. Tous les minéraux d’un même groupe et du même numéro final sont de même type structural. Le numéro de type structural a une particularité : c’est toujours un multiple de 5.<br> |
Vous trouverez ci-dessous une arborescence partielle de la famille numéro 5 de la classification de Nickel-Strunz 10ème édition. La subdivision 5.AB très riche a été raccourcie pour tenir sur une seule page.<br> | Vous trouverez ci-dessous une arborescence partielle de la famille numéro 5 de la classification de Nickel-Strunz 10ème édition. La subdivision 5.AB très riche a été raccourcie pour tenir sur une seule page.<br> | ||
<center>[[image:Strunz10.PNG]]</center> | <center>[[image:Strunz10.PNG]]</center> | ||
| − | Cette classification est complexe mais elle n’est jamais montrée explicitement de cette façon dans les ouvrages de minéralogie.<br> | + | Cette classification est complexe, mais elle n’est jamais montrée explicitement de cette façon dans les ouvrages de [[minéralogie]].<br> |
| − | < | + | <h2> La classification de Dana 8ème édition </h2> |
| − | Dans la classification de Dana 8ème édition moins complexe que la précédente, les minéraux sont rangés en 79 familles d’anions et d’associations d’anions. Chaque famille d’anion est scindée en sous- | + | Dans la classification de Dana 8ème édition, moins complexe que la précédente, les minéraux sont rangés en 79 familles d’anions et d’associations d’anions. Chaque famille d’anion est scindée en sous-familles faisant référence à une composition caractéristique. Enfin ces sous-familles donnent accès aux minéraux qui sont alors rangés par types structuraux.<br> |
| − | Ainsi le minéral 14.1.1.5 est le 5ème minéral du type structural 1 de la sous famille 14.1 de formule caractéristique A( | + | Ainsi le minéral 14.1.1.5 est le 5ème minéral du type structural 1 de la sous famille 14.1 de formule caractéristique A(XO<sub>3</sub>) de la famille des carbonates anhydres simples. Ce minéral est la sphérocobaltite de formule CoCO<sub>3</sub>.<br> |
<center>[[image:Dana.PNG]]</center> | <center>[[image:Dana.PNG]]</center> | ||
| Ligne 42 : | Ligne 43 : | ||
Cette classification est plus efficace que la Nickel-Strunz 10ème édition. En effet, le type structural est clairement identifié par un numéro simple qui n’est pas un multiple de 5. On peut lire directement le nombre de types structuraux existants et le nombre de minéraux adoptants ce type structural. La classification de Nickel-Strunz possède 4 niveaux de lecture alors que la classification de Dana 8ème édition n’en a plus que trois ce qui facilite la lecture. Le fait de ranger les minéraux par composition chimique caractéristique est aussi très pratique.<br> | Cette classification est plus efficace que la Nickel-Strunz 10ème édition. En effet, le type structural est clairement identifié par un numéro simple qui n’est pas un multiple de 5. On peut lire directement le nombre de types structuraux existants et le nombre de minéraux adoptants ce type structural. La classification de Nickel-Strunz possède 4 niveaux de lecture alors que la classification de Dana 8ème édition n’en a plus que trois ce qui facilite la lecture. Le fait de ranger les minéraux par composition chimique caractéristique est aussi très pratique.<br> | ||
| − | < | + | <h2> La classification de Hey 3ème édition </h2> |
| − | Le principe de classement de Hey s’articule sur 31 | + | Le principe de classement de Hey s’articule sur 31 familles d’anions ou d’associations d’anions. Chaque famille d’anions est ensuite subdivisée en familles de cations. Illustrons cela avec les carbonates. Les carbonates sont dans deux familles, les carbonates simples et les carbonates associés à d’autres anions. Cela constitue la 11ème et 12ème famille de la classification. La famille numéro 11 des carbonates simples se divise en 14 sous-familles suivant les cations associés à l’anion carbonate. Dans la quatrième sous-famille des carbonates de calcium, on trouve 8 minéraux. L’arborescence que nous venons de décrire est présentée ci-dessous.<br> |
<center>[[image:Hey.PNG]]</center> | <center>[[image:Hey.PNG]]</center> | ||
| − | Cette classification est aussi très simple à lire comme la classification de Dana 8ème édition. Il y a 3 niveaux de lecture. Cependant elle contient moins | + | Cette classification est aussi très simple à lire comme la classification de Dana 8ème édition. Il y a 3 niveaux de lecture. Cependant elle contient moins d’informations que la classification de Dana : les types structuraux et les compositions chimiques caractéristiques sont absents. Son originalité réside dans le fait que les minéraux sont rangés par anions et cations. Il est alors possible d’effectuer des recherches plus ciblées si des tests ont permis d’avoir une idée de la composition chimique d’un échantillon inconnu.<br> |
<hr> | <hr> | ||
| − | <font color= | + | <font color=green>Voir aussi </font>[[Compléments sur la dureté, la densité et l'indice de réfraction]] |
<hr> | <hr> | ||
| − | <font color=" | + | <font color="green">Retour à </font>[[Lexique des termes employés en minéralogie]] |
<hr> | <hr> | ||
| − | <font color=" | + | <font color="green">Retour au</font> [[Portail Minéralogie]] |
Version actuelle datée du 1 juillet 2022 à 21:04
Sommaire
De la composition chimique aux classes minérales
Approche de la classification de Nickel-Strunz 10ème édition
L’étude des compositions chimiques des minéraux permet de créer d’autres façons de les ranger en plus de leur système cristallin. Pour introduire et développer le concept de classe minérale, nous ferons donc un peu de chimie et comme nous l’avons toujours fait jusqu’à maintenant, prenons deux cas simples : le soufre natif et la pyrite. Le premier est exclusivement composé de soufre : S, le second est composé de fer et de soufre : FeS2. On peut donc trouver au moins deux classes générales de minéraux : les minéraux « simples » et les minéraux composés. En minéralogie, la classe des minéraux simples est appelée « Éléments natifs ». Par contre, il existe de nombreuses façons d’obtenir des minéraux composés. Étudions le cas du fer dans différents minéraux :

On peut voir dans le tableau, des compositions chimiques relativement complexes où le fer est associé à 1, 2 voire 3 autres atomes. Mais cela ne suffit pas à établir une classification valable, il faut aller un peu plus loin en chimie. Nous allons donc introduire un concept nouveau : les ions.
Qu’est-ce qu’un ion ? Nous sommes familiers des atomes avec lesquels nous jouons depuis le début. Les atomes sont constitués d’un centre appelé noyau, avec une charge globale positive et d’un cortège d’électrons avec une charge globale négative. Comme la nature est bien faite, le nombre de charges négatives portées par les électrons compense le nombre de charges positives du noyau ; on parle alors de neutralité de l’atome. Par exemple, le fer possède 26 électrons pour compenser les 26 charges positives de son noyau. Mais suivant les cas, il peut en perdre deux ou trois, et se retrouver avec une charge globale positive : c’est une oxydation. On parle alors de cations et dans le cas du fer on le notera Fe2+ ou Fe3+ suivant qu’il ait perdu 2 ou 3 électrons.
Le cas contraire peut aussi se produire c'est-à-dire un gain d’électron. Le chlore possède 17 électrons pour compenser les 17 charges positives de son noyau et il arrive fréquemment que ce dernier gagne un électron, c’est une réduction. Sa charge globale devient négative, on obtient ce que l’on appelle un anion que l’on notera pour le cas du chlore Cl-. Ainsi à partir de ces deux exemples, on appelle ion, toute molécule ou tout atome ayant perdu ou gagné des électrons. Cet objet maintenant introduit va nous permettre d’aller plus loin dans notre étude. Complétons le tableau précédent avec cette nouvelle notion de cations et d’anions.

Ce tableau montre que l’on peut ranger les minéraux à partir des anions présents dans le cristal. Le nom des anions donnera le nom de la classe minérale. Ce type de classification où les anions sont utilisés pour créer une classe minérale, est plus judicieux qu’une classification par cation car souvent c’est l’anion qui va imposer la structure cristalline. Par exemple, les carbonates de magnésium (MgCO3, magnésite ), de calcium (CaCO3, Calcite ) et de cobalt (CoCO3, sphaérocobaltite ) ont la même structure cristalline, il est donc logique de les classer ensemble en plus de leur anion CO32- commun.
Nous avons cité précédemment les éléments natifs. Maintenant nous pouvons ajouter les classes que nous avons trouvées dans le tableau. Un initié devrait se rendre compte qu’il manque trois classes : les halogénures, les borates et les minéraux organiques. Les halogénures sont issus de l’union entre un halogène et un cation. Les halogènes courants sont les suivants : Fluor F, Chlore Cl, Brome Br et l’Iode I. Les deux minéraux les plus connus de la famille des halogénures sont la fluorine de formule CaF2 et le sel de table appeler plus rigoureusement halite de formule NaCl. Les minéraux organiques sont eux essentiellement constitués d’oxygène, de carbone, d’azote et d’hydrogène. L’ambre est un minéral organique aussi connu que répandu. Les borates sont peu communs, il s’agit de l’union de l’anion (BO3)3- avec un ou des cations. L’un des borates les plus connus est l’ulexite encore appelée « la pierre télévision ». Le tableau qui suit récapitule toutes les classes minérales que nous avons trouvées ensemble.
Les classes minérales sont en fait bien plus complexes car le nombre d’anions existants est assez important. Ils rentrent cependant tous dans l’une des dix classes minérales que nous avons trouvées précédemment. Le tableau présent sur la page suivante résume les sous-classes présentes dans les classes principales, les anions associés et un minéral représentatif de la sous-classe. Ce tableau n’est ni exhaustif ni fondamental pour la suite de l’article.
Il y a d’autres classifications où l’ambre n’est pas considéré comme un minéral, comme dans les classifications de Hey 3ème édition et celle de Dana 8ème édition détaillées plus loin.
La classification de Nickel-Strunz 10ème édition
Vous avez été initié à la classification de Nickel-Strunz dans la partie précédente. C’est cette classification que j’ai choisie de vous présenter en premier car c’est la plus utilisée dans les livres de minéralogie destinés aux passionnés. Cependant elle est plus complexe que cela. Je vous propose donc d’aller plus loin dans les détails de cette classification.
Dans cette classification, tous les minéraux sont rangés dans 10 familles d’anions identifiées par un numéro de 1 à 10, nous l’avons déjà vu précédemment. Dans chaque famille on trouve des sous-familles constituées des anions qui ont des propriétés chimiques, géométriques ainsi qu’une charge similaires. Ces sous-familles sont identifiées par une lettre ajoutée au numéro de la famille principale. Enfin chaque sous-famille est subdivisée en fonction des cations, des autres anions associés, de groupements formulaires typiques, etc. Pour identifier ces subdivisions une lettre supplémentaire est ajoutée à l’identifiant de la sous-famille. Enfin les minéraux contenus dans ces dernières subdivisions reçoivent un numéro qui fait référence à un type structural.
Cela permet d’identifier chaque minéral par un numéro, par exemple la calcite a pour identifiant 5.AB.05. La calcite appartient à la famille 5 du groupe 5.AB des carbonates d’alcalino-terreux et autres cations divalents et le chiffre 05 désigne le type structural. Tous les minéraux d’un même groupe et du même numéro final sont de même type structural. Le numéro de type structural a une particularité : c’est toujours un multiple de 5.
Vous trouverez ci-dessous une arborescence partielle de la famille numéro 5 de la classification de Nickel-Strunz 10ème édition. La subdivision 5.AB très riche a été raccourcie pour tenir sur une seule page.

Cette classification est complexe, mais elle n’est jamais montrée explicitement de cette façon dans les ouvrages de minéralogie.
La classification de Dana 8ème édition
Dans la classification de Dana 8ème édition, moins complexe que la précédente, les minéraux sont rangés en 79 familles d’anions et d’associations d’anions. Chaque famille d’anion est scindée en sous-familles faisant référence à une composition caractéristique. Enfin ces sous-familles donnent accès aux minéraux qui sont alors rangés par types structuraux.
Ainsi le minéral 14.1.1.5 est le 5ème minéral du type structural 1 de la sous famille 14.1 de formule caractéristique A(XO3) de la famille des carbonates anhydres simples. Ce minéral est la sphérocobaltite de formule CoCO3.

Cette classification est plus efficace que la Nickel-Strunz 10ème édition. En effet, le type structural est clairement identifié par un numéro simple qui n’est pas un multiple de 5. On peut lire directement le nombre de types structuraux existants et le nombre de minéraux adoptants ce type structural. La classification de Nickel-Strunz possède 4 niveaux de lecture alors que la classification de Dana 8ème édition n’en a plus que trois ce qui facilite la lecture. Le fait de ranger les minéraux par composition chimique caractéristique est aussi très pratique.
La classification de Hey 3ème édition
Le principe de classement de Hey s’articule sur 31 familles d’anions ou d’associations d’anions. Chaque famille d’anions est ensuite subdivisée en familles de cations. Illustrons cela avec les carbonates. Les carbonates sont dans deux familles, les carbonates simples et les carbonates associés à d’autres anions. Cela constitue la 11ème et 12ème famille de la classification. La famille numéro 11 des carbonates simples se divise en 14 sous-familles suivant les cations associés à l’anion carbonate. Dans la quatrième sous-famille des carbonates de calcium, on trouve 8 minéraux. L’arborescence que nous venons de décrire est présentée ci-dessous.

Cette classification est aussi très simple à lire comme la classification de Dana 8ème édition. Il y a 3 niveaux de lecture. Cependant elle contient moins d’informations que la classification de Dana : les types structuraux et les compositions chimiques caractéristiques sont absents. Son originalité réside dans le fait que les minéraux sont rangés par anions et cations. Il est alors possible d’effectuer des recherches plus ciblées si des tests ont permis d’avoir une idée de la composition chimique d’un échantillon inconnu.
Voir aussi Compléments sur la dureté, la densité et l'indice de réfraction
Retour à Lexique des termes employés en minéralogie
Retour au Portail Minéralogie