FORMULES CHIMIQUES : Différence entre versions
| (43 révisions intermédiaires par 4 utilisateurs non affichées) | |||
| Ligne 1 : | Ligne 1 : | ||
| − | + | __NOEDITSECTION__ | |
| − | Les [[minéraux]] ont une composition chimique bien déterminée, exprimée par une formule chimique. Cette formule est idéalisée, c'est-à-dire qu'elle ne mentionne que les principaux composants du minéral. Les très petites inclusions ou impuretés naturelles, qui peuvent influencer la couleur ou même la faire changer, ne sont pas prises en compte. | + | ===Composition chimique=== |
| − | + | Les [[minéraux]] ont une composition chimique bien déterminée, exprimée par une formule chimique. Cette formule est idéalisée, c'est-à-dire qu'elle ne mentionne que les principaux composants du minéral. Les très petites inclusions ou impuretés naturelles, qui peuvent influencer la couleur ou même la faire changer, ne sont pas prises en compte. (Voir aussi à [[Chimie]]). | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| + | ====Atome, ion et élément==== | ||
| + | |||
| + | La découverte de l'atome est due à des philosophes de l'[[Antiquité]], tels que Leucippe et Démocrite, qui (pour tenter de répondre aux questions concernant le début et la fin du cosmos, l'unité et la diversité des êtres matériels), ont trouvé un dénominateur commun pour tous les êtres, pour tout l'[[Univers]] : l'atome. Au fil des années et des siècles, cette volonté de comprendre l'origine du monde a contribué à considérer l'atome comme un objet physique par les physiciens. Cette unité de matière, aussi petite qu'elle soit, a permis de faire un grand pas dans la compréhension de notre [[Univers]] et est encore au centre de nombreuses recherches.</br> | ||
| + | </br> | ||
| + | *<b>Un atome</b> est un assemblage de protons, de charge positive, et de neutrons, de charge nulle, le tout entouré d'électrons de charge électrique négative. Un atome est constitué de particules élémentaires plus petites : des électrons, des protons et des neutrons. Mais il constitue la plus petite unité indivisible d'un [[élément]] chimique.<br> | ||
| + | <center>[[Image:Atome_bis.jpg]]</center> | ||
| + | Les atomes sont les plus petites parties d'un corps simple. Si d'aventure un électron est arraché à l'atome, il y a une charge '''+e''' excédentaire, on a ce que l'on appelle un «ion positif» ou «cation». Si par contre l'atome capture un électron qui passait par là, il y a une charge '''-e''' excédentaire, on a ce que l'on appelle un «ion négatif» ou «anion». Mais le noyau est inchangé, on a toujours le même élément chimique avec le même numéro atomique.<br>(<font color="green">voir aussi l'</font>[[Origine des éléments]]) | ||
| + | |||
| + | *<b>Un ion</b> est un atome qui a perdu ou gagné un ou plusieurs électrons ; il n'est plus neutre électriquement. | ||
| + | |||
| + | *<b>Un [[élément]]</b> est une catégorie d'atomes ayants en commun le même nombre de protons dans leur noyau atomique. On connaît 118 éléments actuellement (avec le 117 dont la découverte est confirmée début 2010). Parmi ces éléménts, 94 existent à l'état naturel sur [[Terre]] (<font color="green">Voir la liste à</font>[[Liste alphabétique des éléments naturels]]), ils sont regroupés en : [[métaux]], [[non-métaux]] et [[métalloïdes]]. (<font color="green">Voir aussi à :</font>[[Tableau périodique des éléments]]). | ||
| + | |||
| + | *<b>Les symboles chimiques</b> : Chaque élément est désigné par un code d'une lettre capitale, ou de deux lettres dont la première est une capitale et la seconde une minuscule ; c'est le symbole chimique. Par exemple : l'[[hydrogène]] est désigné par '''H''', le [[carbone]] par '''C''', l'[[azote]] par '''N''' , l'[[oxygène]] par '''O''', le [[sodium]] par '''Na''' ), le [[fer]] par '''Fe''', le [[calcium]] par '''Ca''' ... Le chimiste suédois Jöns Jacob [[Berzelius]] (1779-1848) est à l'origine des symboles chimiques. <br> | ||
| − | + | *<b>Masse atomique</b> : La masse atomique d'un [[élément]] est la masse d'un atome de cet élément. La masse atomique d'un élément chimique est la moyenne des masses atomiques de ses [[isotope]]s au prorata de leur présence dans la nature. | |
| − | [[Image: | + | <center> [[Image:Masse_atomique2.jpg]]</center><br> |
| − | |||
| − | < | ||
=====Liaison ionique===== | =====Liaison ionique===== | ||
On sait que les objets ayant une charge opposée s'attirent, et que les objets ayant une charge de même signe se repoussent. Les '''+''' se repoussent entre eux, les '''-''' se repoussent entre eux, mais un '''+''' et un '''-''' s'attirent (force de Coulomb). Les ions se baladant dans la nature vont donc être attirés par des ions ayant une charge opposée, ils vont former un édifice électriquement neutre. Cette attraction électrostatique forme ce que l'on appelle la «liaison ionique». Elle est à l'origine de la cristallisation du sel.<br> | On sait que les objets ayant une charge opposée s'attirent, et que les objets ayant une charge de même signe se repoussent. Les '''+''' se repoussent entre eux, les '''-''' se repoussent entre eux, mais un '''+''' et un '''-''' s'attirent (force de Coulomb). Les ions se baladant dans la nature vont donc être attirés par des ions ayant une charge opposée, ils vont former un édifice électriquement neutre. Cette attraction électrostatique forme ce que l'on appelle la «liaison ionique». Elle est à l'origine de la cristallisation du sel.<br> | ||
| − | Ainsi, les ions sodium Na+ et les ions chlore Cl- s'associent pour former le chlorure de sodium NaCl (édifice neutre), qui n'est autre que le sel de cuisine ([[halite]]). Les ions sont empilés en alternance, de sorte qu'un ion + n'est entouré que d'ions -, et un ion - n'est entouré que d'ions +. | + | Ainsi, les ions [[sodium]] Na+ et les ions [[chlore]] Cl- s'associent pour former le chlorure de sodium NaCl (édifice neutre), qui n'est autre que le sel de cuisine ([[halite]]). Les ions sont empilés en alternance, de sorte qu'un ion + n'est entouré que d'ions -, et un ion - n'est entouré que d'ions +. |
=====Liaison moléculaire===== | =====Liaison moléculaire===== | ||
| − | Plutôt que de voler un électron à un autre atome comme dans le cas d'une réaction électrochimique, il peut y avoir une mise en commun d'un électron (chaque atome apporte un électron qu'il partage avec l'autre atome). C'est la liaison moléculaire ou '''liaison covalente'''.<br> | + | Plutôt que de voler un électron à un autre atome, comme dans le cas d'une réaction électrochimique, il peut y avoir une mise en commun d'un électron (chaque atome apporte un électron qu'il partage avec l'autre atome). C'est la liaison moléculaire ou '''liaison covalente'''.<br> |
| − | *Les deux atomes peuvent être identiques, alors, on met un'''2''' en indice du symbole chimique pour indiquer que la molécule contient deux atomes identiques : p.ex. les gaz dihydrogène H'''<sub>2</sub>''' | + | *Les deux atomes peuvent être identiques, alors, on met un'''2''' en indice du symbole chimique pour indiquer que la molécule contient deux atomes identiques : p. ex. les gaz dihydrogène (H'''<sub>2</sub>''') et dioxygène (O'''<sub>2</sub>'''). |
| − | *Les atomes peuvent aussi être différents, on accole alors les deux symboles chimiques : p.ex. le monoxyde de carbone CO, le chlorure d'hydrogène HCl. | + | *Les atomes peuvent aussi être différents, on accole alors les deux symboles chimiques : p. ex. le monoxyde de [[carbone]] '''CO''', le chlorure d'[[hydrogène]] '''HCl'''. |
| − | Un atome peut partager ses électrons avec plusieurs autres atomes, le carbone peut ainsi partager jusqu'à 4 électrons. Dans le cas de l'eau, l'atome d'oxygène partage deux électrons, un avec chaque atome d'hydrogène : H<sub>2</sub>O. | + | Un atome peut partager ses électrons avec plusieurs autres atomes, le carbone peut ainsi partager jusqu'à 4 électrons. Dans le cas de l'[[eau]], l'atome d'oxygène partage deux électrons, un avec chaque atome d'hydrogène : '''H<sub>2</sub>O'''. |
| − | ==== | + | ====Tableau périodique des éléments==== |
| − | < | + | <center>[[Image:Elements_bis.jpg|815px]]</center><br> |
| − | + | <font color="green">Voir le tableau en plus grand à :</font>[[tableau éléments]]<br> | |
| + | <font color="green">Voir un tableau plus récent à :</font> [[tableau périodique des éléments]]. | ||
| − | Les | + | ===Formules chimiques=== |
| − | + | <b>La formule chimique</b> des minéraux, est la représentation par le nombre et la nature des atomes constituant le minéral. Par convention, on note les cations à gauche, puis le groupe anionique, puis les ions hydroxyles.<br><b>Les éléments</b> se combinent pour faire tous les [[minéraux]] et [[roche]]s trouvés dans la [[croûte]] terrestre. Les huit éléments principaux sont : [[oxygène]] '''O''', [[silicium]] '''Si''', [[aluminium]] '''Al''', [[fer]] '''Fe''', [[calcium]] '''Ca''', [[sodium]] '''Na''', [[potassium]] '''K''', et [[magnésium]] '''Mg'''.<br> | |
| − | + | Le silicium '''Si''' se combine avec deux atomes de l'oxygène '''O''' pour donner '''SiO<sub>2</sub>''' pour faire du [[quartz]], ou de la silice, et de là tous les minéraux silicatés (<font color="#0000FF">Voir aussi à</font> [[Silicates]]). | |
| − | + | Les minéraux peuvent être composés : | |
| − | + | *d'un élément simple, comme le [[diamant]], qui est fait de [[carbone]] C, formule chimique : '''C''' ; | |
| + | *de deux éléments ,ou plus, comme le quartz, qui contient un silicium Si et deux atomes d'oxygène O, formule chimique : '''SiO<sub>2</sub>'''. | ||
| − | + | ====L'analyse chimique==== | |
| − | |||
| + | Le point de départ est une [[analyse chimique]]. La composition définie indique qu'une analyse chimique d'un minéral donné produira toujours le même taux d'éléments. Par exemple, le quartz aura toujours un silicium '''Si''' pour chaque groupe de deux atomes d'oxygène '''O'''. Par conséquent, les minéraux peuvent être exprimés par des formules chimiques, telles que SiO<sub>2</sub> pour le quartz. | ||
| + | Dans certains minéraux, les éléments sont de taille et de charge semblable, ils se remplacent l'un l'autre. La quantité de [[fer]] et [[magnésium]] dans l'[[olivine]] varie parce que ces éléments peuvent se remplacer l'un l'autre dans la structure du minéral. La formule de l’olivine, qui est un nom général pour un mélange (une [[solution solide]]) entre deux pôles principaux, la [[forstérite]] '''MgSiO<sub>4</sub>''' et la [[fayalite]] '''FeSiO<sub>4</sub>''', indique que pour chaque groupe de deux atomes de magnésium et/ou de fer, il y a un atome de silicium et quatre atomes d'oxygène.<br> | ||
| + | Généralement, une formule d’[[olivine]] est écrite '''(Mg,Fe)<sub>2</sub>SiO<sub>4</sub>'''. | ||
| − | ==== | + | ====Formules chimiques des principaux minéraux==== |
{| class="wikitable" width="100%" align="center" | {| class="wikitable" width="100%" align="center" | ||
<hr> | <hr> | ||
| − | |+<b><font color=" | + | |+<b><font color="green"><big>FORMULES CHIMIQUES des PRINCIPAUX MINERAUX</big></font></b> (travail à compléter)<br> Pour chaque [[minéral]], consultez les [[fiches minéraux]]. |
<hr> | <hr> | ||
| − | |width: | + | |width:50%| |
| | | | ||
| − | *<b>I | + | *<b>[[I ÉLÉMENTS NATIFS]]</b> |
| − | **Les métaux | + | **Les [[métaux]] |
***argent Ag | ***argent Ag | ||
***cuivre Cu | ***cuivre Cu | ||
| Ligne 57 : | Ligne 67 : | ||
***platine Pt | ***platine Pt | ||
***plomb Pb | ***plomb Pb | ||
| − | **Les métalloïdes | + | **Les [[métalloïdes]] |
***arsenic As | ***arsenic As | ||
***antimoine Sb | ***antimoine Sb | ||
| − | **Les non-métaux | + | **Les [[non-métaux]] |
***diamant C | ***diamant C | ||
***graphite C | ***graphite C | ||
***soufre S | ***soufre S | ||
| − | *<b>II | + | *<b>[[II SULFURES]] </b> |
**Sulfures | **Sulfures | ||
***acanthite Ag<sub>2</sub>S | ***acanthite Ag<sub>2</sub>S | ||
| Ligne 93 : | Ligne 103 : | ||
***tennantite Cu<sub>3</sub>AsS<sub>3</sub> | ***tennantite Cu<sub>3</sub>AsS<sub>3</sub> | ||
***tétraédrite Cu<sub>3</sub>SbS<sub>3</sub> | ***tétraédrite Cu<sub>3</sub>SbS<sub>3</sub> | ||
| − | *<b>III | + | *<b>[[III HALOGÉNURES]] </b> |
| + | ***atacamite Cu<sub>2</sub>Cl(OH)<sub>3</sub> | ||
| + | ***boléite K Pb<sub>26</sub>Ag<sub>9</sub>Cu<sub>24</sub>Cl<sub>62</sub>(OH)<sub>48</sub> | ||
| + | ***fluorine CaF<sub>2</sub> | ||
| + | ***halite NaCl | ||
| + | ***sylvine KCl | ||
| + | *<b>[[IV OXYDES]] et Hydroxydes </b> | ||
***anatase TiO<sub>2</sub> | ***anatase TiO<sub>2</sub> | ||
***brookite TiO<sub>2</sub> | ***brookite TiO<sub>2</sub> | ||
| Ligne 111 : | Ligne 127 : | ||
***spinelle Al<sub>2</sub>MgO<sub>4</sub> | ***spinelle Al<sub>2</sub>MgO<sub>4</sub> | ||
***tantalite (Fe,Mn) (Ta,Nb)<sub>2</sub>O<sub>6</sub> | ***tantalite (Fe,Mn) (Ta,Nb)<sub>2</sub>O<sub>6</sub> | ||
| − | + | *<b>[[V CARBONATES]]</b> | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | *<b>V | ||
***ankérite Ca(Fe,Mg,Mn)(CO<sub>3</sub>)<sub>2</sub> | ***ankérite Ca(Fe,Mg,Mn)(CO<sub>3</sub>)<sub>2</sub> | ||
***aragonite CaCO<sub>3</sub> | ***aragonite CaCO<sub>3</sub> | ||
| Ligne 134 : | Ligne 142 : | ||
***sidérite FeCO<sub>3</sub> | ***sidérite FeCO<sub>3</sub> | ||
***smithsonite ZnCO<sub>3</sub> | ***smithsonite ZnCO<sub>3</sub> | ||
| − | *<b> | + | |width:50%| |
| + | | | ||
| + | *<b>[[VI SULFATES]]</b> | ||
**Sulfates | **Sulfates | ||
***anglésite PbSO<sub>4</sub> | ***anglésite PbSO<sub>4</sub> | ||
| Ligne 151 : | Ligne 161 : | ||
***wolframite (Mn, Fe)WO<sub>4</sub> | ***wolframite (Mn, Fe)WO<sub>4</sub> | ||
***scheelite CaWO<sub>4</sub> | ***scheelite CaWO<sub>4</sub> | ||
| − | *<b> | + | *<b>[[VII PHOSPHATES]]</b> |
**Phosphates | **Phosphates | ||
***apatite Ca<sub>5</sub>(PO<sub>4</sub>)<sub>3</sub>(OH,F,Cl) | ***apatite Ca<sub>5</sub>(PO<sub>4</sub>)<sub>3</sub>(OH,F,Cl) | ||
| Ligne 172 : | Ligne 182 : | ||
***vanadinite Pb<sub>5</sub> [Cl | (VO<sub>4</sub>)3] | ***vanadinite Pb<sub>5</sub> [Cl | (VO<sub>4</sub>)3] | ||
***descloizite Pb (Zn,Cu) [OH | (VO<sub>4</sub>)] | ***descloizite Pb (Zn,Cu) [OH | (VO<sub>4</sub>)] | ||
| − | + | *<b>[[VIII SILICATES]] </b> | |
| − | |||
| − | *<b> | ||
**Tectosilicates | **Tectosilicates | ||
***feldspath : | ***feldspath : | ||
| Ligne 185 : | Ligne 193 : | ||
****scolécite Ca Al<sub>2</sub> Si<sub>3</sub>O<sub>10</sub>. <sub>3</sub> H<sub>2</sub>O | ****scolécite Ca Al<sub>2</sub> Si<sub>3</sub>O<sub>10</sub>. <sub>3</sub> H<sub>2</sub>O | ||
***feldspathoïde : | ***feldspathoïde : | ||
| − | ****haüyne | + | ****haüyne NaCa<sub>4</sub>-<sub>8</sub>(SO<sub>4</sub>)<sub>1</sub>-<sub>2</sub>(SiAlO<sub>4</sub>)<sub>6</sub> |
****leucite K(Si<sub>2</sub>AlO<sub>6</sub>) | ****leucite K(Si<sub>2</sub>AlO<sub>6</sub>) | ||
****néphéline Na<sub>3</sub>K(SiAlO<sub>4</sub>) | ****néphéline Na<sub>3</sub>K(SiAlO<sub>4</sub>) | ||
| Ligne 194 : | Ligne 202 : | ||
****natrolite Na<sub>2</sub> Al Si<sub>3</sub> O<sub>10</sub>·<sub>2</sub>H<sub>2</sub>O | ****natrolite Na<sub>2</sub> Al Si<sub>3</sub> O<sub>10</sub>·<sub>2</sub>H<sub>2</sub>O | ||
**Nésosilicates | **Nésosilicates | ||
| − | ***andalousite | + | ***andalousite Al<sub>2</sub>SiO<sub>5</sub> |
| − | ***disthène | + | ***disthène Al2<sub></sub>SiO5<sub></sub> |
| − | ***grenat | + | ***grenat X<sub>3</sub> Y<sub>2</sub> (SiO<sub>4</sub>)<sub>3</sub> (X=Mg, Fe<sup>2</sup>+, Mn, Ca)(Y=Al, Fe<sup>3</sup>+, Cr, Zr, V, Ti ) |
| − | ***péridot ou olivine | + | ***péridot ou olivine X<sub>2</sub> SiO<sub>4</sub> (X=Mg, Ca, Fe, Mn (Zn, Ni, Cr) ) |
| − | ***sillimanite | + | ***sillimanite Al<sub>2</sub>SiO<sub>5</sub> |
| − | ***staurotide ( | + | ***staurotide (Fe<sup>2</sup>+)<sub>2</sub> Al<sub>9</sub>O<sub>6</sub> (O, OH)<sub>2</sub> [SiO<sub>4</sub>]<sub>4</sub> |
| − | ***topaze | + | ***topaze Al<sub>2</sub> (F, OH)<sub>2</sub> [SiO<sub>4</sub>] |
| − | ***titanite CaTi | + | ***titanite CaTi SiO<sub>4</sub> |
| − | ***zircon | + | ***zircon ZrSiO<sub>4</sub> |
**Sorosilicates | **Sorosilicates | ||
| − | ***épidote | + | ***épidote Ca<sub>2</sub>Fe<sup>3</sup>+ Al<sub>2</sub> (O, OH) SiO<sub>4</sub> Si<sub>2</sub>O<sub>7</sub> |
| − | ***zoïsite | + | ***zoïsite Ca<sub>2</sub>Al<sub>3</sub> [O | OH | SiO<sub>4</sub> | Si<sub>2</sub>O<sub>7</sub>] |
**Cyclosilicates | **Cyclosilicates | ||
| − | ***axinite Ca | + | ***axinite Ca Fe<sub>3</sub> Mn Al<sub>2</sub> [BO<sub>3</sub> OH | SiO<sub>4</sub> O<sub>12</sub>] |
| − | ***béryl | + | ***béryl Al<sub>2</sub> [Be<sub>3</sub> Si<sub>6</sub> O<sub>18</sub>] |
| − | ***cordiérite | + | ***cordiérite Mg<sub>2</sub>Al<sub>3</sub> (Al Si<sub>5</sub> O<sub>18</sub>) |
| − | ***dioptase | + | ***dioptase Cu<sub>6</sub> (Si<sub>6</sub>O<sub>18</sub>).<sub>6</sub>H<sub>2</sub>O |
| − | ***tourmaline | + | ***tourmaline Y<sub>3</sub>Al<sub>6</sub> Na (OH, F)<sub>4</sub> (BO<sub>3</sub>)<sub>3</sub> Si<sub>6</sub>O<sub>18</sub> (Y=Mg ,Fe,Mn.Al,Li) |
**Inosilicates | **Inosilicates | ||
***amphibole : | ***amphibole : | ||
| − | ****amphibole ferromagnésienne (Mg, Fe)7 [ | + | ****amphibole ferromagnésienne (Mg, Fe)<sub>7</sub> [Si<sub>8</sub>O<sub>22</sub>] (OH,F)<sub>2</sub> |
****amphibole calcique : | ****amphibole calcique : | ||
| − | *****trémolite | + | *****trémolite Ca<sub>2</sub> Mg<sub>5</sub> [Si<sub>8</sub>O<sub>22</sub>] (OH,F)<sub>2</sub> |
| − | *****actinote | + | *****actinote Ca<sub>2</sub> (Mg,Fe)<sub>5</sub> [Si<sub>8</sub>O<sub>22</sub>] (OH,F)<sub>2</sub> |
| − | *****hornblende (Ca,Na,K)2 (Mg, | + | *****hornblende (Ca,Na,K)<sub>2</sub> (Mg,Fe<sup>2</sup>+,Fe<sup>3</sup>+,Al)<sub>5</sub> [Si<sub>6</sub>(Si,Al)<sub>2</sub>O<sub>22</sub>] (OH,F)<sub>2</sub> |
****amphibole sodique : | ****amphibole sodique : | ||
| − | *****glaucophane | + | *****glaucophane Na<sub>2</sub> Mg<sub>3</sub> Al<sub>2</sub> [Si<sub>8</sub>O<sub>22</sub>] OH<sub>2</sub> |
| − | *****riébéckite | + | *****riébéckite Na<sub>2</sub> Fe<sup>2</sup>+<sub>3</sub> Fe<sup>3</sup>+<sub>2</sub> [Si<sub>8</sub>O<sub>22</sub>] (OH,F)<sub>2</sub> |
***pyroxène | ***pyroxène | ||
| − | ****rhodonite Ca | + | ****rhodonite Ca Mn<sub>4</sub> (Si<sub>5</sub>O<sub>15</sub>) |
| − | ****wollastonite | + | ****wollastonite Ca<sub>3</sub> (Si<sub>3</sub>O<sub>9</sub>) |
**Phyllosilicates | **Phyllosilicates | ||
| − | ***apophyllite | + | ***apophyllite KFCa<sub>8</sub> Si<sub>8</sub>O<sub>20</sub>.<sub>8</sub> H<sub>2</sub>O |
| − | ***mica | + | ***mica XY<sub>2</sub>-<sub>3</sub>Z<sub>4</sub>O<sub>10</sub>(OH,F)<sub>2</sub> |
| − | ***biotite K(Mg,Fe)3 | + | ***biotite K(Mg,Fe)<sub>3</sub> Si<sub>3</sub>AlO<sub>10</sub> (OH,F)<sub>2</sub> |
| − | ***muscovite | + | ***muscovite KAl<sub>2</sub> Si<sub>3</sub>AlO<sub>10</sub> (OH,F)2<sub>2</sub> |
| − | ***Lépidolite K (Li,Al3) | + | ***Lépidolite K (Li,Al3<sub></sub>) Si3<sub></sub>AlO10<sub></sub> (OH,F)<sub></sub> |
| − | ***Phlogopite K | + | ***Phlogopite K Mg<sub>3</sub> Si<sub>3</sub>AlO<sub>10</sub> (OH)<sub>2</sub> |
| − | ***serpentine | + | ***serpentine Mg<sub>6</sub> [Si<sub>4</sub>O<sub>10</sub>(OH)<sub>2</sub>] (OH)<sub>6</sub> |
|} | |} | ||
<hr> | <hr> | ||
| − | <font color=" | + | <font color="green">Retour aux différentes </font>[[listes]] |
| + | <font color="green">Voir aussi à</font> [[Liste alphabétique des éléments naturels]] | ||
<hr> | <hr> | ||
| Ligne 254 : | Ligne 263 : | ||
| align="center" | '''et aussi''' | | align="center" | '''et aussi''' | ||
|- | |- | ||
| − | | align="center" style="font-size: 100%;" | [[Vocabulaire géologique]] | [[Lexique des termes employés en minéralogie]] | [[Lexique volcanologique]] [[ | + | | align="center" style="font-size: 100%;" | [[Vocabulaire géologique]] | [[Lexique des termes employés en minéralogie]] | [[Lexique volcanologique]]<br> [[Fiches de présentation des roches]] |
|} | |} | ||
Version actuelle datée du 29 décembre 2020 à 21:16
Sommaire
Composition chimique
Les minéraux ont une composition chimique bien déterminée, exprimée par une formule chimique. Cette formule est idéalisée, c'est-à-dire qu'elle ne mentionne que les principaux composants du minéral. Les très petites inclusions ou impuretés naturelles, qui peuvent influencer la couleur ou même la faire changer, ne sont pas prises en compte. (Voir aussi à Chimie).
Atome, ion et élément
La découverte de l'atome est due à des philosophes de l'Antiquité, tels que Leucippe et Démocrite, qui (pour tenter de répondre aux questions concernant le début et la fin du cosmos, l'unité et la diversité des êtres matériels), ont trouvé un dénominateur commun pour tous les êtres, pour tout l'Univers : l'atome. Au fil des années et des siècles, cette volonté de comprendre l'origine du monde a contribué à considérer l'atome comme un objet physique par les physiciens. Cette unité de matière, aussi petite qu'elle soit, a permis de faire un grand pas dans la compréhension de notre Univers et est encore au centre de nombreuses recherches.
- Un atome est un assemblage de protons, de charge positive, et de neutrons, de charge nulle, le tout entouré d'électrons de charge électrique négative. Un atome est constitué de particules élémentaires plus petites : des électrons, des protons et des neutrons. Mais il constitue la plus petite unité indivisible d'un élément chimique.

Les atomes sont les plus petites parties d'un corps simple. Si d'aventure un électron est arraché à l'atome, il y a une charge +e excédentaire, on a ce que l'on appelle un «ion positif» ou «cation». Si par contre l'atome capture un électron qui passait par là, il y a une charge -e excédentaire, on a ce que l'on appelle un «ion négatif» ou «anion». Mais le noyau est inchangé, on a toujours le même élément chimique avec le même numéro atomique.
(voir aussi l'Origine des éléments)
- Un ion est un atome qui a perdu ou gagné un ou plusieurs électrons ; il n'est plus neutre électriquement.
- Un élément est une catégorie d'atomes ayants en commun le même nombre de protons dans leur noyau atomique. On connaît 118 éléments actuellement (avec le 117 dont la découverte est confirmée début 2010). Parmi ces éléménts, 94 existent à l'état naturel sur Terre (Voir la liste àListe alphabétique des éléments naturels), ils sont regroupés en : métaux, non-métaux et métalloïdes. (Voir aussi à :Tableau périodique des éléments).
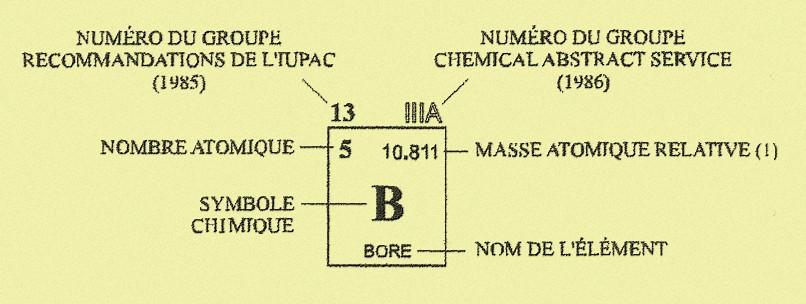
- Les symboles chimiques : Chaque élément est désigné par un code d'une lettre capitale, ou de deux lettres dont la première est une capitale et la seconde une minuscule ; c'est le symbole chimique. Par exemple : l'hydrogène est désigné par H, le carbone par C, l'azote par N , l'oxygène par O, le sodium par Na ), le fer par Fe, le calcium par Ca ... Le chimiste suédois Jöns Jacob Berzelius (1779-1848) est à l'origine des symboles chimiques.
- Masse atomique : La masse atomique d'un élément est la masse d'un atome de cet élément. La masse atomique d'un élément chimique est la moyenne des masses atomiques de ses isotopes au prorata de leur présence dans la nature.
Liaison ionique
On sait que les objets ayant une charge opposée s'attirent, et que les objets ayant une charge de même signe se repoussent. Les + se repoussent entre eux, les - se repoussent entre eux, mais un + et un - s'attirent (force de Coulomb). Les ions se baladant dans la nature vont donc être attirés par des ions ayant une charge opposée, ils vont former un édifice électriquement neutre. Cette attraction électrostatique forme ce que l'on appelle la «liaison ionique». Elle est à l'origine de la cristallisation du sel.
Ainsi, les ions sodium Na+ et les ions chlore Cl- s'associent pour former le chlorure de sodium NaCl (édifice neutre), qui n'est autre que le sel de cuisine (halite). Les ions sont empilés en alternance, de sorte qu'un ion + n'est entouré que d'ions -, et un ion - n'est entouré que d'ions +.
Liaison moléculaire
Plutôt que de voler un électron à un autre atome, comme dans le cas d'une réaction électrochimique, il peut y avoir une mise en commun d'un électron (chaque atome apporte un électron qu'il partage avec l'autre atome). C'est la liaison moléculaire ou liaison covalente.
- Les deux atomes peuvent être identiques, alors, on met un2 en indice du symbole chimique pour indiquer que la molécule contient deux atomes identiques : p. ex. les gaz dihydrogène (H2) et dioxygène (O2).
- Les atomes peuvent aussi être différents, on accole alors les deux symboles chimiques : p. ex. le monoxyde de carbone CO, le chlorure d'hydrogène HCl.
Un atome peut partager ses électrons avec plusieurs autres atomes, le carbone peut ainsi partager jusqu'à 4 électrons. Dans le cas de l'eau, l'atome d'oxygène partage deux électrons, un avec chaque atome d'hydrogène : H2O.
Tableau périodique des éléments

Voir le tableau en plus grand à :tableau éléments
Voir un tableau plus récent à : tableau périodique des éléments.
Formules chimiques
La formule chimique des minéraux, est la représentation par le nombre et la nature des atomes constituant le minéral. Par convention, on note les cations à gauche, puis le groupe anionique, puis les ions hydroxyles.
Les éléments se combinent pour faire tous les minéraux et roches trouvés dans la croûte terrestre. Les huit éléments principaux sont : oxygène O, silicium Si, aluminium Al, fer Fe, calcium Ca, sodium Na, potassium K, et magnésium Mg.
Le silicium Si se combine avec deux atomes de l'oxygène O pour donner SiO2 pour faire du quartz, ou de la silice, et de là tous les minéraux silicatés (Voir aussi à Silicates).
Les minéraux peuvent être composés :
- d'un élément simple, comme le diamant, qui est fait de carbone C, formule chimique : C ;
- de deux éléments ,ou plus, comme le quartz, qui contient un silicium Si et deux atomes d'oxygène O, formule chimique : SiO2.
L'analyse chimique
Le point de départ est une analyse chimique. La composition définie indique qu'une analyse chimique d'un minéral donné produira toujours le même taux d'éléments. Par exemple, le quartz aura toujours un silicium Si pour chaque groupe de deux atomes d'oxygène O. Par conséquent, les minéraux peuvent être exprimés par des formules chimiques, telles que SiO2 pour le quartz.
Dans certains minéraux, les éléments sont de taille et de charge semblable, ils se remplacent l'un l'autre. La quantité de fer et magnésium dans l'olivine varie parce que ces éléments peuvent se remplacer l'un l'autre dans la structure du minéral. La formule de l’olivine, qui est un nom général pour un mélange (une solution solide) entre deux pôles principaux, la forstérite MgSiO4 et la fayalite FeSiO4, indique que pour chaque groupe de deux atomes de magnésium et/ou de fer, il y a un atome de silicium et quatre atomes d'oxygène.
Généralement, une formule d’olivine est écrite (Mg,Fe)2SiO4.
Formules chimiques des principaux minéraux
|
|
Retour aux différentes listes Voir aussi à Liste alphabétique des éléments naturels
| à voir aussi pour en apprendre plus sur les minéraux et les roches | ||
|
la détermination des minéraux | Classification Chimique des minéraux | silicates | Roche | ||
|
La cristallographie | systèmes cristallins | Cristal | Les macles | Troncatures
|